Hidrácidos. Características y usos de estos compuestos
Saludos estimados amigos de steemit y apreciados lectores.
Características de los hidrácidos
Físicas
- Son solubles en agua. En general los hidrácidos son muy solubles en agua, dando lugar a soluciones transparentes o amarillentas dependiendo de la concentración de la solución.
- Desprenden vapores densos. Visiblemente se puede apreciar, al destapar una botella con una solución concentrada de un hidrácido, la emanación de vapores. Esto se debe a la facilidad con la que reaccionan con el vapor de agua en el ambiente.
- Sus soluciones conducen la electricidad. Aunque de forma anhidra son compuestos gaseosos, forman soluciones electrolíticas al disolverse en agua, por lo cual liberan iones que permiten el paso de la corriente eléctrica.
Químicas
- Forman soluciones muy ácidas. Estos compuestos tienen una gran facilidad para donar protones (en forma de iones hidronio)
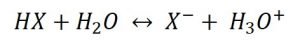
En esta reacción de equilibrio, si la reacción es termodinámicamente favorecida hacia la derecha, el HX liberará su protón, el cual será aceptado por el agua para dar el H3O+.
- Fortaleza de los hidrácidos. Dependiendo de elemento no metálico al cual se encuentre unido el hidrógeno, el hidrácido será fuerte o débil. Por ejemplo, cuando hablamos del ácido fluorhídrico (HF), el flúor es un elemento muy electronegativo, por lo que acorta la distancia de enlace con el átomo de hidrógeno, dificultando la ruptura del enlace para ceder el protón en agua, además, hay un mejor traslape entre estos átomos por razones del tamaño de los mismos, otros halógenos como el cloro, el bromo o el yodo, tienen radios atómicos más grandes, por lo que poseen orbitales más voluminosos, por lo que presentan un enlace más débil con el hidrógeno, haciendo mayor su tendencia a disociarse completamente en agua.
Nomenclatura
En sus formas anhidras, gaseosos, se nombran añadiendo la terminación “uro” al no metal, seguido de la palabra hidrógeno. Por ejemplo. El HCl, consiste de un haluro formado por cloro e hidrógeno, por lo que se nombra como cloruro de hidrógeno.
En cambio, cuando el haluro se encuentra en disolución acuosa, se obtiene como tal el hidrácido. Para nombrarlo, basta con sustituir el sufijo uro por hídrico y se antepone la palabra ácido; así, el HCl(ac) se nombra como ácido clorhídrico.
¿Cuáles son los hidrácidos?
No son muchos los ejemplos que podemos encontrar, ya que las combinaciones naturales de estos compuestos son muy limitadas, siendo ellos los siguientes:
- Ácido sulfhídrico (H2S): es la solución acusa del sulfuro de hidrógeno, es altamente tóxico y presenta un fuerte olor huevo podrido. Este es un hidrácido poliatómico, es decir, compuesto de más de dos átomos, sin embargo se sigue considerando binario ya que está compuesto solo de dos elementos, S y H.
- Ácido clorhídrico (HCl): es uno de los más conocidos, muy utilizado en productos de limpieza y forma parte de la composición de los jugos gástricos. Este se caracteriza por un fuerte olor y sabor agrio.
- Ácido fluorhídrico (HF): este hidrácido forma fuertes puentes de hidrógeno, a tal punto que en agua es un ácido débil. Es uno de los ácidos más peligrosos y corrosivos, conocido por atacar el vidrio. Sus soluciones son incoloras y con densidad similar al agua, tiene un olor agudo y penetrante.
- Ácido Bromhídrico (HBr): este es un ácido muy fuerte y volátil, producto de la solución acuosa del bromuro de hidrógeno.
- Ácido selenhídrico: es la disolución del seleniuro de hidrógeno, con un olor irritante y sumamente venenoso.
- Ácido yodhídrico (HY): resultante de la disolución del yoduro de hidrógeno, posee la peculiaridad de ser irritante y corrosivo.
- Ácido telurhídrico: el telurio tiene cierto carácter metálico, sin embargo la solución del telurio de hidrógeno es muy venenosa y altamente condensable.
Usos
Son muy utilizados como productos limpiadores, en esencia son ácidos fuertes, por lo que sus protones ácidos se asocian con los compuestos de las impurezas haciéndolos más solubles y haciendo posible que puedan desprenderse de las superficies.

Pero deben utilizarse con moderación y seleccionando apropiadamente el tipo de ácido, por ejemplo el ácido clorhídrico es un buen removedor de manchas de baldosas y piezas sanitarias.
Son utilizados como catalizadores ácidos en diversas reacciones, en la industria petrolera se emplean los hidrácidos en diversos procesos de refinación. También son muy utilizados para la síntesis de haluros de compuestos orgánicos específicos, que luego pueden tener aplicaciones muy diversas como la síntesis de polímeros.
Referencias:
Atkins, P., Jones, L. (2006). Principios de química. Editorial Médica Panamericana S.A.
Wikipedia.com. Acido
Wikipedia.com. Ácidos hidrácidos
Posted from my blog with SteemPress : https://moronej.000webhostapp.com/2019/02/hidracidos-caracteristicas-y-usos-de-estos-compuestos