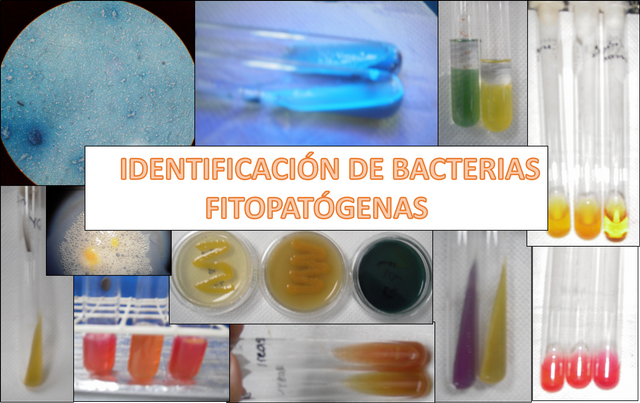
IDENTIFICACIÓN DE BACTERIAS FITOPATÓGENAS

INTRODUCCIÓN
Para el presente protocolo de laboratorio nos centraremos en el género Xanthomonas, se clasifica en la familia Pseudomonadaceae. Las células son bastones rectos por lo general dentro del rango de 0,4 a 0,7 de ancho x 0,7 a 1,8 um de longitud. Son Gram negativos, aerobios y móviles por un flagelo polar único. Las colonias son de color amarillo, suave y viscosa. Para su identificación es necesario considerar diversos métodos, como son: morfológicos, tinciones, características culturales, características fisiológicas, características bioquímicas, patogenicidad, serología, técnicas moleculares, relaciones con respecto a fagos, entre otros
Identificar géneros de bacterias de interés fitopatógeno (Xanthomonas), realizando diferentes pruebas tanto presuntivas, como culturales, fisiológicas y bioquímicas, a fin de facilitar el reconocimiento de estos microorganismos, ya sea a nivel de géneros como de especies.
Tinción de rojo congo:
El tamaño de la mayoría de las células bacterianas es tal que resultan difíciles de ver con el microscopio óptico. La principal dificultad es la falta de contraste entre la célula y el medio que la rodea, y el medio más simple de aumentar el contraste es la utilización de colorantes. La mayoría de los colorantes son compuestos orgánicos que tienen alguna afinidad específica por los materiales celulares. Muchos colorantes utilizados con frecuencia son moléculas cargadas positivamente (cationes) y se combinan con intensidad con los constituyentes celulares cargados negativamente. Otros colorantes son moléculas cargadas negativameute (aniones) y se combinan con los constituyentes celulares cargados positivamente, esos colorantes incluyen el rojo Congo. La tinción de rojo congo consiste en dejan sin teñir las células, pero se colorea en cambio el medio que las rodea. Lo que se ve, por tanto, es el perfil de las células.
Prueba del KOH:
Esta prueba consiste en separar a las bacterias en Gram negativas y Gram positivas. Las bacterias Gram negativas (-) se caracterizan por contener una capa de lipoproteínas más lipopolisacaridos sobre la capa peptidoglucano y presentan una capa muy fina, al aplicar el KOH al 3% produce el vaciado del interior de la célula hacia fuera, dando como resultado la formación de un hilo. Las Gram positiva (+) no se forma este hilo debido a que ellas presentan una pared celular más gruesa.
Agar dextrosa rojo fenol:
Consiste en un cambio de pH, debido a la producción de ácidos por parte de las bacterias, a causa de un proceso fermentativo. El resultado se basa en el tipo de coloración que se torne el medio, un cambio del color rojo hacia el amarillo es tomado como positiva (ácida), mientras que una coloración roja es tomada como negativa (alcalina). El procedimiento seguido se repitió con cada una de las muestras.
Producción de H2S:
Esta prueba se basa en la capacidad que presentan algunas bacterias de degradar el aminoácido cistina y otros compuestos ricos en azufre con la formación de H2S, donde los metales reaccionan con el gas y producen una coloración oscura (Sulfuro del metal).
Crecimiento anaerobiotico (Hugh y Leifson):
El medio Hugh y Leifson, es un medio base que permite la adición de un azúcar para estudiar el tipo de metabolismo que tiene el microorganismo. Si el microorganismo es capaz de utilizar el azúcar producirá ácidos y por tanto cambiara el medio de cultivo a un color amarillo.
Medio para determinar aerobiosis:
Se basa en el crecimiento de la bacteria en la parte superior del líquido, lo que indica que requiera de oxigeno libre, es decir que es un microorganismo aerobio, el crecimiento a lo largo del tubo indica el desarrollo de un microorganismo anaerobio facultativo y en el fondo del tubo anaerobio.
Prueba de la catalasa:
La catalasa es una enzima que descompone al peróxido de hidrógeno en oxígeno y agua, la base de esta prueba es demostrar la presencia de la enzima catalasa. Esta prueba se realiza añadiendo de 2 a 3 gotas de agua oxigenada a la suspensión bacteriana, observándose el desprendimiento de burbujas gaseosas de O2.
Prueba de la oxidasa:
La oxidasa es una enzima, la cual es capar de oxidar el tetrametil-p-phenylendiamina dihydrocloro, demostrando asi la presencia de citocromo C en la cadena respiratoria, la cual activa citocromos reducidos por oxígeno molecular, por la transferencia de un aceptor al estado terminal del sistema de transferencia de electrones. El sistema de citocromos está generalmente presente en organismos aeróbicos. Un resultado positivo a la oxidasa consiste en una serie de reacciones en las cuales un componente auto-oxidable del sistema de citocromo es al final catalizado.
Hidrólisis del almidón:
Los polisacaridos, como el almidón son demasiados largos para ser transportados al interior de la célula. Los microorganismos excretan amilasas que hidrolizan esos polímeros hasta oligo o monosacáridos que pueden usarse como sustratos para crecer. La hidrólisis de almidón es analizada en medios conteniendo almidón en placa.
Prueba de licuefacción de la gelatina
La enzima responsable en esta reacción es la gelatinosa, esta ocaciona la perdida de las propiedades de la gelatina (proteína de colágeno) de gelificarse
Medio para la prueba de fermentación de carbohidratos:
Se basa la producción de ácido o gas, durante el crecimiento fermentativo con azúcares o alcoholes.
Prueba de indol:
Es la capacidad de la bacteria en transformar el triptófano a indol
Prueba de la ureasa:
La ureasa es una enzima que desdobla la urea en amoníaco y dióxido de carbono. Se visualiza el proceso debido a que la alcalinidad que se produce origina un cambio de color en el indicador que lleva incorporado el medio
Hidrólisis de la Esculina:
La esculina contiene un carbohidrato unido a un compuesto aromático. La hidrólisis de la esculina la convierte en esculetina la cual con iones hierro forma un complejo de color verde oliva hasta negro.
Medios selectivos para Xanthomonas:
• D5 de Kado y Heskett: es utilizado para las razas de X. campestres
• Sx: hidrólisis del almidón
Para el desarrollo del protocolo para la identificación de una bacteria fitopatógena, se seleccionó una cepa bacteriana procedente de la colección del Laboratorio de Bacterias Fitopatógenas del Postgrado de Agronomía de la UCLA. La misma se identificó como cepa M-2.
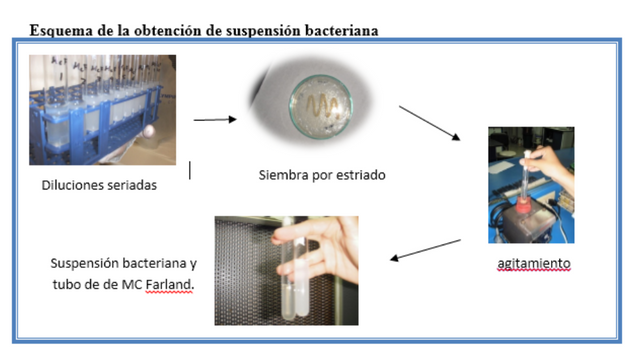
Diluciones seriadas.
Se realizaron diluciones (10-1 hasta 10-6) de cultivos de bacterias para obtener colonias puras, en el cual se toma una serie de tubos de ensayos esterilizados con sus respectivas tapas (7 tubos), al tubo inicial se le agrega 3ml de agua destilada estéril y al resto 9ml de agua destilada estéril, al tubo inicial se le agrega una ansada de la cepa bacteriana y se agita, posteriormente se toma 1 ml de la solución inicial, la misma es transferida al primer tubo (denotado 10-1), sucesivamente se realiza el mismo procedimiento hasta finalizar la serie de tubos de ensayo. Luego se toma una alícuota de 0,1 ml de las diluciones 10-4 y 10-6 y se siembra en una placa Petri con agar nutritivo (AN), la misma se distribuye en toda la placa con ayuda de un drigalaky estéril.

Diluciones seriadas y colonias formadas en la placa Petri despues de 24 horas
1. Pruebas Presuntivas
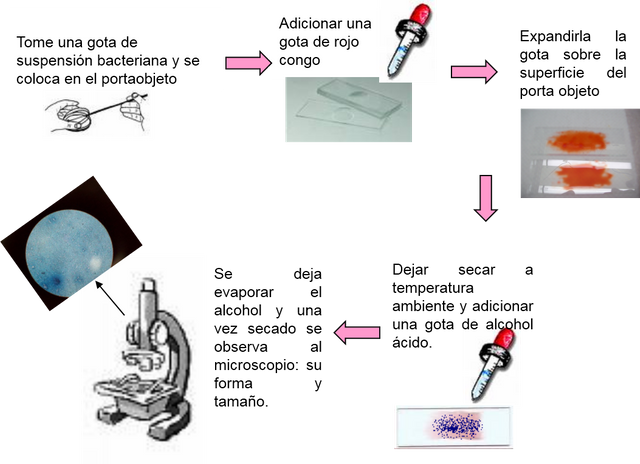
Tinción de rojo congo.
Se toma una ansada de la suspensión bacteriana y se coloca en el porteobjeto, adicionando una gota de rojo congo, luego se expande la gota sobre la superficie del porta objeto, dejando secar a temperatura ambiente. Posteriormente se le agrega una gota de alcohol ácido y se deja evaporar el alcohol y una vez secado se observa al microscopio: su forma y tamaño.
Prueba del KOH.
Se toman porciones del cultivo bacteriano en su fase exponencial y se colocan en un porta objeto, el cual contenía una gota de hidróxido de potasio (KOH) al 3%. Utilizando el ansa de platino, se le da unos movimientos circulares y se levanta durante 3seg. Si la mezcla forma un hilo, se afirma que es una bacteria Gram- (forma mucílago), mientras que las bacterias Gram + no forman el hilo característico.
2. Pruebas Culturales
Estas consisten en establecer características de crecimiento de las colonias como borde, elevación, consistencia y color de las cepas.
Una vez que se obtengan colonias bacterianas puras, se procede a realizar simultáneamente siembras a través de la técnica en estriado en medios culturales como Agar nutritivo (AN) y dextrosa extracto de levadura (YDC), se sellan y se dejan a temperatura ambiente.
3. Pruebas Fisiológicas y Bioquímicas
Agar dextrosa rojo fenol:
Con un asa de platino se transfiere una porción de la cepa M-2 de 48 horas, se coloca en tubos con el medio, se sella y se deja a temperatura ambiente. El resultado se basa en el tipo de coloración que se torne el medio, un cambio del color rojo hacia el amarillo es tomado como positiva (ácida), mientras que una coloración roja es tomada como negativa (alcalina).
Producción de H2S
Se prepara un medio a base de extracto de levadura carbonato agar (YCA), 4 ml del este son colocados en tubos de ensayos, se deja solidificar. Una vez solidificado se toma una ansada del crecimiento bacteriano y se siembra en el medio, haciéndola en forma de zig- zag o estriado. Posteriormente se coloca una tira de papel de acetato de plomo dentro del tubo, se sella y se deja incubar la bacteria por 3 a 5 días a temperatura ambiente. La reacción se toma como positiva, cuando el papel de acetato se torna de color negro.
Crecimiento anaerobiotico (Hugh y Leifson)
Se prepara el medio base y se añade 5 ml en los tubos de ensayo, se toma una ansada de la colonia bacteriana y luego se añade 2ml de parafina estéril al tubo de ensayo. La prueba resulta positiva si se observa cambio de color verde a amarillo indicando que la bacteria es anaeróbica, mientras que resulta negativa, si no se produce ningún cambio de color en el medio.
Medio para determinar aerobiosis (Bactotieglicolato)
Se transfiere una ansada de la suspensión bacteriana del cultivo de 48 horas de crecimiento a un tubo con el medio, se incuba a temperatura ambiente.
Prueba de la catalasa
Se agrega una ansada del crecimiento bacteriano a una lámina portaobjetos a la cual se le añade unas gotas de solución de Peróxido de hidrógeno (H2O2) al 3%, y se observa a través de una lupa estereoscópica. La reacción se toma como positiva al observarse la formación de burbujas de gas.
Prueba de la oxidasa
Se utilizan colonias de 24 horas de crecimiento en AN suplementado con 1% de glucosa, para ello se utiliza papel filtro impregnado con una solución de Tetramethyl-p-phenylenediamine dihyclroride al 1% recién preparado. Seguidamente se frota el ansa con la bacteria sobre el papel durante un lapso de 10 a 60 seg. La bacteria es oxidasa positiva si aparece un color violeta intenso en un tiempo de 10 seg, débilmente positiva si la coloración se desarrolla en 10-60 seg y negativa si no hay desarrollo de color después de transcurridos los 60 seg.
Hidrólisis del almidón
Se usa una placa Petri que contenga un médio Agar-almidón se siembra la cepa bacteriana en forma de zig–zag, se dejan durante 5 días a temperatura ambiente. Posteriormente se agrega una solución de Iodine. La bacteria que desdobla el almidón induce una zona clara alrededor del estriado, tomándose la misma como positiva; mientras que las bacterias que no degradan el almidón se observa el medio totalmente oscuro.
Prueba de licuefacción de la gelatina
Se utiliza un tubo de ensayo que contenga gelatina, en donde se le realiza una serie de punzadas con un ansa de platino, la cual contiene la suspensión bacteriana en su fase exponencial, se sella y se deja a temperatura ambiente. Transcurrido 3, 7, 14, y 21 días, los tubos se colocan a 4°C en la nevera por 30 minutos y se observa la reacción. Es positiva si se observa el medio en estado líquido.
Medio base con carbohidrato al 1%
Se preparar un medio base, y se vacía en tubos de ensayo esterilizados, seguidamente a cada tubo de ensayo se le adicionan 1 mL de la solución, igualmente se prepara cada uno de los carbohidratos a utilizar al 0.6%. Se adicionan 2 mL de carbohidrato a utilizar, y con ayuda de un ansa de platino se realizan varias punzadas en el medio, se sella y se deja a temperatura ambiente. El procedimiento se repite con cada carbohidrato que se desea probar. Los carbohidratos utilizados fueron: Glucosa, arabinosa y manosa, utilizados para diferenciar especies del género Xanthomonas (ya que la cepa asiganada corresponden a este género). Tubos con color amarillo se consideran como positivos y un color rosado negativo. El tubo positivo muestra la presencia de ácido (color amarillo) y gas, mientras que el tubo negativo no cambia de color.
Prueba de la ureasa
Para esta prueba se utiliza un medio base agar más urea, el mismo se dispensa en tubos e inocula con la bacteria en estado exponencial, la formación de un color rojo violeta es tomado como positivo.
Hidrólisis de la Esculina
Crecen las bacterias en un medio complejo que contiene 0,01 % de esculina y un 0,05 de citrato férrico. La hidrólisis se completa si hay ausencia de fluorescencia cuando se ve con luz UV, en ese caso es positiva.
Medios selectivos para Xanthomonas
D5 de kado y Heskett
SX: Se prepara un medio de SX agar y se vacía en las placas Petri, se siembra la bacteria, toma una ansada de la cepa en su estado exponencial y se observa su crecimiento en la placa.
4. Prueba de patogenicidad
Para la prueba de patogenicidad se utilizaran 6 plantas jovenes y sanas de pimenton, sembradas en embases plasticos, con tierra esterilizada. El inoculo se obtiene de una suspención de cultivo puro en su fase exponencial (24-28 h de crecimiento) y a una concentración aproximada de 108 ufc ml-1

La inoculación se realiza utilizandose una inyectadora para causar las heridas (Con herida), posteriormente se utilizó un algodón embebido en la suspensión bacteriana para mojar las hojas, se utilizo otro metodo de inoculación el cual consistio en utilizar un algodón embebido en la suspensión bacteriana para mojar las hojas (sin heridad). Esta se realizo en la tardecita, alrededos de las 5 pm para darle a las plantas mayores condiciones de humedad.


Luego de inoculadas las plantas fueron colocadas en camara húmeda por 48 horas. Se realizaron observaciones diariamente y compararon con las dos plantas controles o plantas testigos (inoculadas solamente con agua), las dos inoculadas con herida y otras dos sin herida, las cuales se les brindaron las mismas condiciones ambientales.
Diluciones seriadas.
Hubo desarrollo de colonias en los platos Petri, formándose de manera aislada, se desarrollaron aproximadamente una vez transcurridas las 24 horas en la dilución 10-4, en la dilución de 10-6 no se observa un crecimiento de la cepa M-2. Posteriormente una vez desarrollada la colonia se procedió a obtener el crecimiento bacteriano en fase exponencial, para realizar las respectivas pruebas presuntivas (fig.1).

Fig. Nº 1. Cepa bacteriana M-2, crecimiento de colonias a partir de una dilución seriada.
1. Pruebas Presuntivas
Al obtenerse la formación de colonias, y estas a su vez llevadas a su fase exponencial, se procedió a realizar las pruebas presuntivas, la cual dieron los siguientes resultados:
Tinción de rojo congo: se observó una bacteria en forma de bastones cortos (fig.2).
Prueba del KOH: se obtuvo como resultado una bacteria del grupo Gram negativa(fig.2).
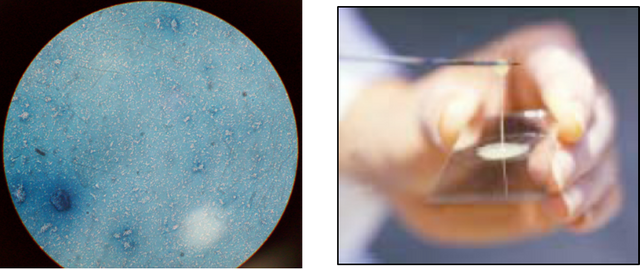
Fig. Nº 2. A: Tinción de rojo congo, forma y tamaño de la bacteria. B: Prueba del KOH, formación del hilo característico.
2. Pruebas Culturales
La cepa M-2 sembrada en medios de Agar nutritivo (AN) y dextrosa extracto de levadura (YDC), dio como resultado el crecimiento de la cepa, presentando una coloración amarilla. Resultados similares se han obtenido con otras bacterias pertenecientes a los géneros Xanthomonas y Pseudomonas (Hernández, 1989) (fig.3).
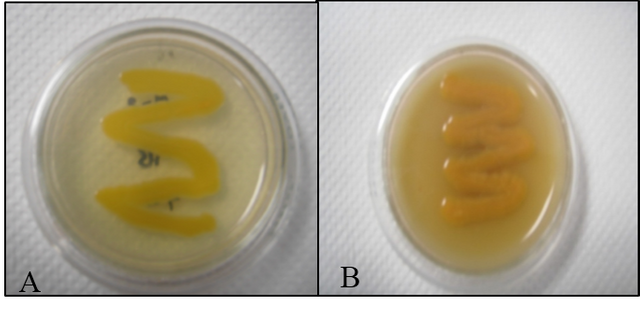
Fig. Nº 3. A: Crecimiento de la cepa M-2 en un medio de Agar Nutritivo (AN). B: Crecimiento de la cepa M-2 en un medio de dextrosa extracto de levadura (YDC).
3. Pruebas Fisiológicas y Bioquímicas
Agar dextrosa rojo fenol:
El agar se torno más rojo, lo que indica una reacción negativa de la cepa bacteriana M-2 (fig.4).
Producción de H2S
Se obtuvo una reacción positiva, ya que la bacteria M-2 es capaz de producir acido sulfhídrico a partir de la cisteína, esto se observa debido a que produce una coloración oscura en el papel de acetato de plomo (fig.4).
Crecimiento anaerobiotico (Hugh y Leifson)
La prueba resulto negativa, ya que no se produjo ningún cambio de color en el medio (fig.4).
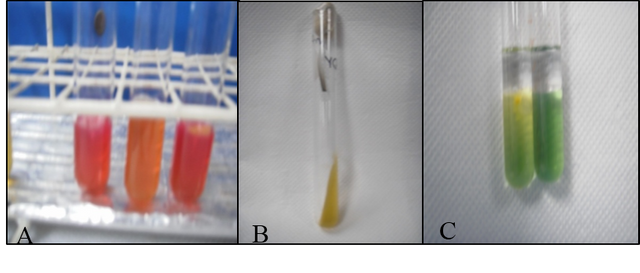
Fig. Nº 4. A: Prueba con Agar dextrosa rojo fenol, reacción negativa (alcalina), B: Producción de H2S, C: Prueba de anaeróbiosis, a la derecha el tubo control y a la izquierda la cepa M-2
Medio para determinar aerobiosis
Se obtuvo un crecimiento en la parte superior del liquido lo que indica la necesidad de oxigeno, por tanto es una bacteria aerobia.
Prueba de la catalasa
La bacteria en estudio resulto ser positiva para esta prueba, ya que, dicha bacteria presentaba la enzima catalasa, por lo que genero una reacción con el peróxido de hidrógeno (fig.5).
Prueba de la oxidasa
La bacteria M-2 resulto se negativa, debido a que no se desarrollo una coloración violeta después de 60 seg.
Hidrólisis del almidón
La reacción resulto ser positiva, ya que la bacteria desdoblo el almidón a maltosa (fig.5).
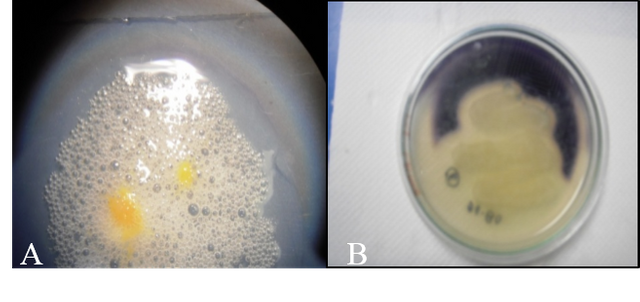
Fig. Nº 5. A: Prueba de la catalaza, se observa la formación de burbuja. B: Hidrólisis del almidón. Presencia de una zona clara alrededos del estriado o de la colonia
Prueba de licuefacción de la gelatina
La prueba dio positiva debido a que se observo que la gelatina estaba en un estado líquido, lo que significa que hidrolizo la gelatina
Medio base con carbohidrato al 1%
Todas las pruebas de fermentación con carbohidrato resultaron positivas, ha excepción del tubo con medio liquido de arabinosa que resulto positivo, incluso el contro cambio de color, por lo que se considera que había la presencia de algún contaminante tanto en el control como en el experimental, ya que en el tubo con medio solido de arabinosa dio positiva la reacción (fig.6-7).


Fig. Nº 6. Prueba de fermentación de carbohidrato (A: Glucosa, B: Manosa y C: Arabinosa), en el centro el control y a los lados los tubos inoculados con la cepa M-2, en medio liquido.
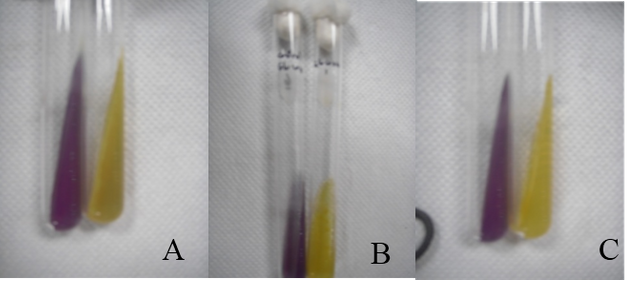
Fig. Nº 7. Prueba de fermentación de carbohidrato (A: Glucosa,B: Manosa, C: Arabinosa respectivamente), a la izquierda el control y a la derecha el tubo inoculado con la cepa M-2, en medio solido
Prueba de la ureasa
La prueba resulto positiva, ya que la cepa bacteriana M-2 hidroliza la urea a amoníaco, observándose mediante el cambio de color de amarrillo a rojo (fig. 8).
Hidrólisis de la esculina
Resulto ser negativa, debido a que la cepa bacteriana M-2 no hidróliza la esculina y no hay ningún cambio de color (fig. 8).
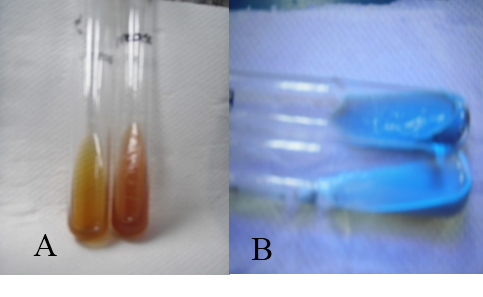
Fig. N° 8. A: Prueba de la ureasa. B: Hidrólisis de la esculina
Medio SX.
La prueba resulto positiva, debido a que se observo la presencia de una zona clara alrededor de la suspensión bacteriana (fig.9).
Medio D5 de kado y Heskett
Se pudo observar que la bacteria creció en el medio diferencial D5 de Kado y Heskett y no en el medio D1 (fig.9).
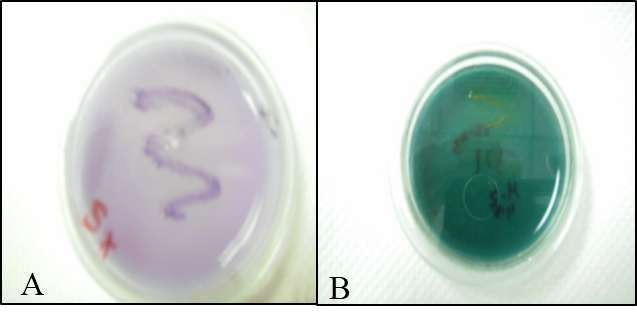
Fig. 9. A: Crecimiento en SX, se observa una zona clara alrededor del crecimiento bacterial. B: Medio D1 de kado y Hesket resulto ser negativa
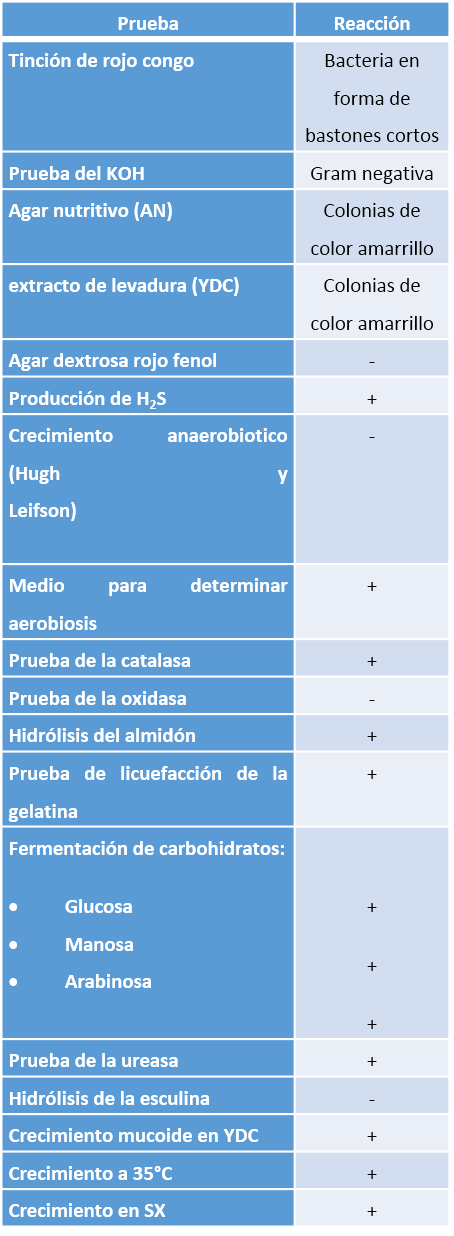
Cuadro Nº 2. Características morfológicas, fisiológicas y bioquímicas de la cepa bacteria M-2
4. Prueba de patogenicidad
No se obtuvieron resultados, es decir, no se presentaron síntomas de la enfermedad, por lo cual no se pudo realizar, el reaislamiento ni la identificación de la bacteria.
• Las pruebas presuntivas (tinción de rojo congo y prueba del KOH), permitieron caracterizar a la cepa bacteriana como Gram negativa, con forma de bastones cortos
• Por medio de las pruebas culturales (medios AN y YDC), se pudo observar las características de las colonias (color).
• La realización de diferentes pruebas fisiológicas y bioquímica, como: el crecimiento a 35 °C, hidrólisis del almidon, fermentación de los carbohidratos (glucosa, manosa y arabinosa), hidrólisis de la esculina, crecimiento en SX y D5, permitió una caracterización más detallada de la cepa bacteriana en estudio, logrando su identificación hasta especie.
• La cepa bacteriana asignada (M-2), por medio de los métodos morfológicos, culturales, fisiológicos y químicos se identifico la bacteria como: Xanthomonas campestris.
• Una vez identificada la bacteria fitopatógena, se recomienda realizar pruebas de patogenicidad, aplicando los postulados de Koch.
• Los métodos de tinción son de gran utilidad, pero deben usarse siempre con precaución, ya que pueden conducir a errores. Las moléculas de colorante forman en ocasiones precipitados o agregados que parecen estructuras celulares auténticas, pero que son formaciones completamente artificiales inducidas por el mismo colorante. Tales estructuras se denominan artefactos, y deben tomarse muchas precauciones para tener la seguridad de que no nos estamos equivocando al creer que un artefacto es una estructura realmente existente.
• Para los métodos fisiológicos y bioquímicos se debe tener sumo cuidado a la hora de realizar los medios de cultivo, debe de hacerse con asepsia y utilizar los materiales esterilizados, evitando la contaminación de estos, ya que esto puede conducir a errores.
Agrios. G. N. 1999. Fitopatología. 2da Edición. Grupo Noriega Editores.
Agrios. G. N. 2005. Plant pathology. Fifth Edition. Editorial Elsevier Academic press.
Bradbury, J.F. 1984. Xanthomonas Dowson. 1939. In: Bergey's manual of systematic Bacteriology, Vol.1. (Krieg, N. R. and Holt, J.G. eds). Williams and Wilkins, Balimore. Pp.199-210.
Carrillo, J., L. Sanchez, R. Garcias, R. Allende y I. Márquez. 2001. Razas de Xanthomonas campestris pv. Vesicatoria (doidge) dye. Presentes en el estado de Sinaloa, México. Revista Méxicana de Fitopatología. 2: 248-250.
Cook, A. y Y. Guevara. 1984. Hypersensitivity in Capsicum chacoense to race 1 of the bacterial spor pathogen of pepper. Plant Disease 68: 329-330.
Contreras, N., G. Trujillo, Y. Hernández y N. Moreno. 1988. bacteriosis en ocumo (xanthosoma sagittifolium (l.) schott) ocasionada por xanthomonas sp. Agronomía Tropical. 38(4-6): 49-56.
De Bauer, M. 1987. Fitopatología. Primera reimpresión. Editorial Limusa S.A.
Divo, A (1998). Microbiología Médica. Interamericana. México.
French, E. y Heber, T. 1980. Métodos en investigación Fitopatologíca. CA. Costa Rica.
FAO. 1986. Manual para patólogos vegetales. CAB. Chile.
Gilchrist, L., G. Fuentes; C. Martínez.; R. López; E. Duveiller; R. Singh; M, Henry y I
García. 2005. Guía practica para la identificación de algunas enfermedades del trigo y cebada. Segunda Edición. México.
Hernández, J. 1989. Bacteriosis en el cultivo del sorgo (Sorghum bicolor (L.) Moench) algunos aspectos epidemiológicos. Tesis Msc. Facultad de Agronomía. U.C.V., Maracay.
Kado, C. y M. Heskett. 1970. Selective media for isolation of Agrobacterium, Corynebacterium, Erwinia, Pseudomonas and Xanthomonas. Phytopathology 60 (6): 969-976
Val, D. 2002. Biología de los microorganismos. http://www.danival.org/presenta.html
Schaad NW, Jones JB, Chun W (2001) Laboratory Guide for Identification of Plant Pathogenic Bacteria. 3a ed. APS Press. St. Paul, MN, EEUU.

This post has been voted on by the SteemSTEM curation team and voting trail in collaboration with @utopian-io and @curie.
If you appreciate the work we are doing then consider voting all three projects for witness by selecting stem.witness, utopian-io and curie!
For additional information please join us on the SteemSTEM discord and to get to know the rest of the community!
Excelente publicación @maribelf. Para nosotros los médicos los cultivos son muy importantes, puesto que el resultado de los mismos no permiten indicar los antibióticos pertinentes y eso puede hacer la diferencia entre mejorarse o no de una enfermedad y en otros caso incluso entre la vida y la muerte.
Por ello, las personas que se dedican a realizarlos cumplen un rol relevante y su trabajo, como bien lo mencionas, debe ser realizado bajo medidas de asepsia, para evitar errores, que a su vez conduzcan a un tratamiento erróneo. Gracias por compartir!
Saludos Dra @elvigia. El paso a paso en el laboratorio es poco visible en las publicaciones científica, y considero es uno de los que amerita más dedicación, ya que pasamos horas en el laboratorio. En mi caso como 'Doctora de plantas' estos análisis de laboratorio nos permiten la determinación de patógenos para evitar pérdidas en el cultivo
¡Felicitaciones!
Te participamos que puedes invertir en el PROYECTO ENTROPÍA mediante tu delegación de Steem Power y así comenzar a recibir ganancias de forma semanal transferidas automáticamente a tu monedero todos los lunes. Entra aquí para más información sobre cómo invertir en ENTROPÍA.
Apoya al trail de @Entropia y así podrás ganar recompensas de curación de forma automática. Entra aquí para más información sobre nuestro trail.
Puedes consultar el reporte diario de curación visitando @entropia.
Atentamente
El equipo de curación del PROYECTO ENTROPÍA
Congratulations @maribelf! You have completed the following achievement on the Steem blockchain and have been rewarded with new badge(s) :
Click here to view your Board
If you no longer want to receive notifications, reply to this comment with the word
STOP✅ Enjoy the vote! For more amazing content, please follow @themadcurator for a chance to receive more free votes!
Saludos @maribelf, muy interesante tu publicación, el rol del Bioanalista en la identificación de bacterias con técnicas apropiadas es primordial para identificar patologías a tiempo y facilitar la actuación del médico, saludos...
Saludos, gracias.
Felicitaciones Farina. Un excelente trabajo de laboratorio y extraordinaria presentación. Que bueno que contemos contigo en steemit. @STEM-Espanol y Cervantes Ciencia ya conocen de tu dedicación y profesionalismo. Que sigan los éxitos @maribelf
Gracias profe por sus palabras, además de mencionar que es parte de mi formación y de mi participación en steemit
Que bien detallado tu post felicidades, excelente material muy completo.
Gracias @anaestrada12