La ciencia cuando se desborda el café caliente
Introducción
En una oportunidad en la mañana de esta semana, coloque un recipiente para hacer café, pero me entretuve haciendo otra cosa y se derramó el café en la cocina, me entro la curiosidad, no de la lógica que si algo se calienta mucho sucede algo, sino cuál sería su explicación en el campo de la ciencia, estuve investigando lo que me sorprendió toda la información que nos muestra esta experiencia en la que encontré: ebullición, energía cinética, punto de ebullición, cambio físico, autoionización del agua, tensión superficial, polaridad (química), fuerza por puente de hidrógeno. Algo importante compañeros lectores es que la base para hacer el café es el agua, esta reacciona a cambio de temperatura y cuando se combina con otra materia y sustancias, en este caso con el café, en cual el café natural en gramos por 100 gr contiene lo siguiente: Celulosa 28,75%, Agua 11,24%, Materias grasas 13,63%, Proteínas (incluida la cafeína) 15,74%, Cafeína 1,16%, Extracto no graso 25,02%, Pentosa y cenizas 4,46%.

Figura 1.- experimento del café calentándolo, 1)en primer lugar en un recipiente colocamos ½ lts de agua y le colocamos dos cucharadas de café molido,2) prendemos la hornilla de la cocina, para calentar el recipiente donde contiene el agua y el café por uno 15 a 25 minutos, para poder ver el punto de ebullición del café disuelto en el agua, 3) y 4) punto de ebullición y sobre-caliento del líquido.
En el experimento de hacer café se observó la ebullición, donde se involucra una transformación de estado líquido a gas, en donde las partículas obtienen una mayor libertad de movimiento en función de un incremento de la energía cinética; pero hay que tomar en cuenta que la temperatura de ebullición, esta va a depender de la presión a la que está sometida el líquido, en este caso el café y el agua juntos, es por ello el calor ejercido sobre la masa del líquido es calor sensible de esta materia. Tomando en cuenta que el agua hierve a 100 o 110 °C, e lo que se denomina punto de ebullición, ya que es la referencia de la temperatura a la cual la presión de vapor del líquido, al mismo tiempo es igual a la presión que rodea al líquido y el líquido se transforma en vapor, es por ello que el calor de la vaporización es la energía requerida para transformar una cantidad dada, en este caso el café contenido en el agua, como líquido en un gas a una presión dada, ya considerando la ebullición y su punto de alcance, ahora que pasa con la salubridad del café contenida en el agua, ya que las moléculas contenidas en ella muestran un comportamiento en cuanto al aumento de la solubilidad en agua, esto se debe al aumentar la temperatura, eso es debido a los cambios de polaridad y junto con la solubilidad de las sustancias moderadamente solubles, esta tiende a aumentar con la temperatura; ya que tienen una alta entalpía de solución.
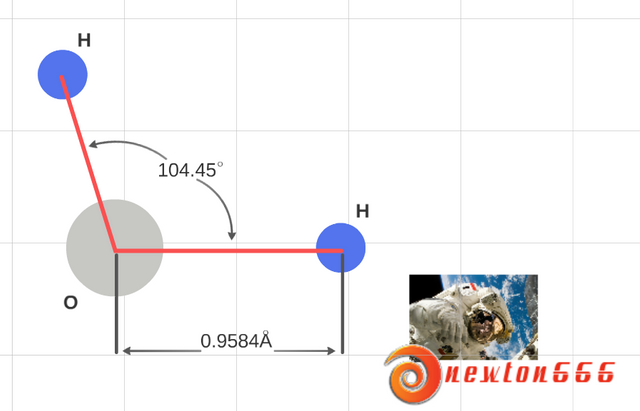
Figura 2.- La geometría de la molécula de agua es la responsable de una buena parte de sus propiedades, por su elevada constante dieléctrica y actuar como dipolo.
Factores que afectan la solubilidad. La solubilidad de una sustancia puede afectarse disminuyendo o aumentando en función de la polaridad y fuerza intermolecular, temperatura, presión y presencia de otras sustancias.Información consultada en Química General Práctica, Página 29.
a.- Efecto de la polaridad y las fuerzas intermolecular: La polaridad es el efecto más importante relacionado con la solubilidad de una sustancia. Por ejemplo regla general se sabe que lo semejantes disuelve lo semejante, es decir, que entre más parecida sean las polaridades del soluto y el solvente, tanto más grande será el valor de la solubilidad.
b.- Efecto de la temperatura: Experimentalmente se sabe que el aumento de la temperatura aumenta proporcionalmente la solubilidad de los sólidos en líquidos y de líquidos en líquidos.
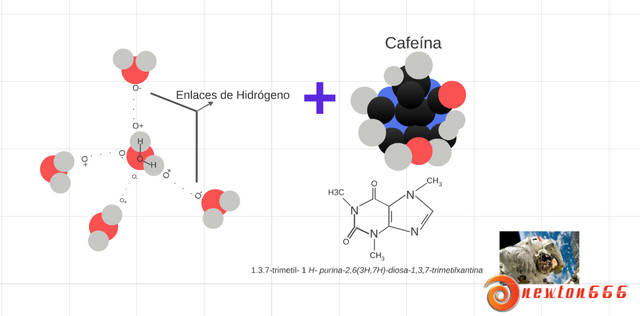
Figura 3.- la molécula del agua y la cafeína
Hay algo muy importante que demos conocer que también ocurre el proceso del punto de ebullición del café hirviendo, hay una constante dieléctrica relativamente elevada 78,5 a 298 K , que está presente en el agua, donde las moléculas de esta sustancia sustancias con carga eléctrica se disocian fácilmente en ella y más cuando esta se une con la cafeína, eso se debe gracia a que hay la presencia de iones disociados incrementa notablemente la conductividad del agua que, pero hay el caso que este un aislante eléctrico en estado puro; pero en nuestro caso esta combinado con la moléculas de la cafeína, la cual contiene: trimetil, purina, diosa y trimetilxantina, haciendo más fácil que las moléculas eléctricamente se disocian fácilmente, también ocurren que se rompen los puente de hidrógeno, por eso burbujea el agua y se expande, al mismo tiempo evaporándose, en una molécula aislada de agua se encuentran dos átomos de hidrógeno y un átomo de oxígeno. Teniendo en cuenta sobre enlace de hidrógeno, el cual es la fuerza eminentemente electrostática atractiva entre un átomo electronegativo, donde a su vez un átomo de hidrógeno unido covalentemente a otro átomo electronegativo, está muy perfecto amigo lectores; pero se tiene conocimiento que cada molécula de agua se compone de dos átomos de hidrógeno unidos por enlaces covalentes a un átomo de oxígeno, está claro que la formación de una fuerza carga-dipolo con un átomo de hidrógeno unido a un átomo de nitrógeno, oxígeno, en nuestro caso se unen con la moléculas de la cafeína, dando como resultante de moléculas de cafeína y las moléculas de agua pueden formar un enlace de hidrógeno entre ellas; estos enlaces por puentes de hidrógeno entre las moléculas del agua son responsables de la dilatación térmica del agua al solidificarse, pero hay una variación de punto de ebullición del agua y el café donde hacen en lo posible un sobre-caliento del agua, en molécula se compone de dos átomos de hidrógeno unidos por enlaces covalentes a un átomo de oxígeno, donde este a llegar a su punto máximo de ebullición rompe los puente hidrógeno, A su vez son responsables de la dilatación térmica de las moléculas.
Aparte ocurre otro fenómeno físico, el cual hace más evidente que se desborde el café, como lo es tensión superficial de un líquido, la cual es la cantidad de energía necesaria para aumentar su superficie por unidad de área, el cual afectan a cada molécula son diferentes en el interior del líquido y en la superficie, de tal manera el café sumergido en el agua, se evidencia que cada molécula está sometida a fuerzas de atracción que en promedio se anulan, tenemos el siguiente aporte consultada en Química 2. Química en acción escrito por Sara Aldabe, Pedro Aramendia, Página 26.
La polaridad de una molécula se mide a través del momento dipolar. Las moléculas polares son aquellas que además de tener enlaces polares no son simétricas.
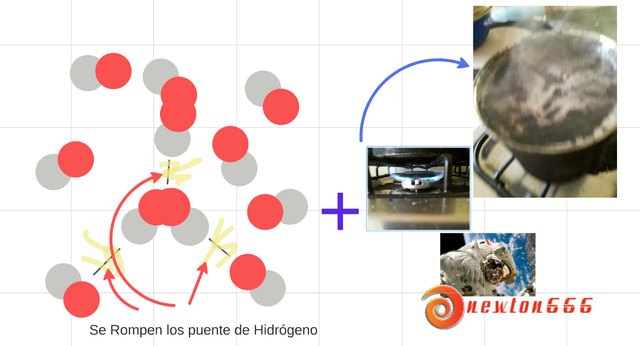
Figura 4.- Aparte de la ebullición del agua y el café también ocurre a nivel molecular se presenta cargas puntuales de igual magnitud; pero de signos opuestos son conocidas como dipolo eléctrico, es un sistema de dos cargas de signo opuesto e igual magnitud cercanas entre sí, es otra reacción que ocurre cuando se rompe los puente de hidrógenos compañeros.
Teniendo claro que la unión de las moléculas del agua y el café establece una red iónica, tiene más consistencia el concepto de polaridad como una propiedad de las moléculas, donde se presenta la separación de las cargas eléctricas en la misma molécula, dado el caso del punto de ebullición, las fuerzas intermoleculares aplicada en ellas, tanto la molécula de café y el agua, hace que ocurra que una molécula de modo enlace covalente el par de electrones, esta tiene la característica de desplazarse hacia el átomo que tiene mayor electronegatividad, le digo tan sencillo que se ve cuando se desborda el café, pero le digo que universo de información aprendimos con este pequeño experimento, con algo de nuestra vida cotidiana.
Todas la imagen fueron elaborada y Autor: @newton666.
Bibliografía consultada.
Química 2. Química en acción escrito por Sara Aldabe, Pedro Aramendia, Página 26.
Química General Práctica, Página 29.
Física: principios con aplicaciones - 2006.

Hello
hello brother
Enfocados en la adopción y promoción de la blockchain de Steem valoramos tu compromiso con ella. Gracias por no hacer Power Down, juntos llevaremos el Steem a la Luna.
Gracias por su apoyo @rutablockchain
This post has been voted on by the SteemSTEM curation team and voting trail. It is elligible for support from @curie.
If you appreciate the work we are doing, then consider supporting our witness stem.witness. Additional witness support to the curie witness would be appreciated as well.
For additional information please join us on the SteemSTEM discord and to get to know the rest of the community!
Please consider setting @steemstem as a beneficiary to your post to get a stronger support.
Please consider using the steemstem.io app to get a stronger support.