Cromatografía de Cuerpo y Ojos en Drosophila melanogaster- Mosca de la fruta.
Esta especie particular de mosca se tomó debido a sus características, ya que tiene un número bajo de cromosomas, una variabilidad fenotípica fácilmente reconocible y cuya ubicación cromosómica es conocida, así como un crecimiento fácil en medios de cultivo simples, lo que facilitó el experimento. y determinar los pigmentos responsables de la coloración de ojos y cuerpo a partir de una cromatografía de capa fina.
Introducción.
Las teorías de la herencia se remontan a los siglos IV y V a. La genética (el estudio científico de la herencia) no comenzó realmente hasta los siglos XVIII y XIX. Básicamente, se observó la transmisión de ciertos caracteres en plantas y animales de generación en generación a fin de proporcionar una base racional para mejorar los cultivos y el ganado.
El avance más significativo en el campo de la genética fue proporcionado por el monje austriaco Gregor Johann Mendel (1822-1884), quien observó ciertas características específicas en las plantas de guisantes, contando el número de individuos en los que aparecieron estos rasgos a lo largo de varias generaciones. Concentrándose en solo unos pocos caracteres y determinando en qué proporción de cada generación estaban presentes, pudo demostrar los patrones básicos específicos de la herencia. El carácter discreto y la segregación independiente de las características genéticas que observó ahora se conocen como las "Leyes de la herencia de Mendel" y se aplican a la mayoría de los sistemas genéticos.
Una de las contribuciones más significativas a la genética fue hecha por Thomas Hunt Morgan (1866-1945), quien reconoció la presencia de cromosomas sexuales y lo que se conoce en genética como "herencia ligada al sexo". También mostró que los factores mendelianos (genes) se organizaron linealmente en los cromosomas. Los experimentos llevados a cabo por Morgan y sus colegas también revelaron la base genética de la determinación del sexo. Morgan continuó sus experimentos y demostró en su "Teoría de genes" que los genes están unidos en diferentes grupos de encadenamiento, y que los alelos (pares de genes que afectan al mismo personaje) se intercambian o entrecruzan dentro del mismo grupo..

Procedimiento experimental.

La cromatografía de los pigmentos de los ojos y los órganos de la mota de Drosophila melanogaster.
Se tomaron 4 papeles de filtro de 23 cm de ancho por 28 cm de alto, en la línea de aplicación sembramos las cabezas y los cuerpos cada uno en diferentes puntos, como se describe a continuación con los símbolos utilizados en la guía de laboratorio para nombrar las mutaciones:
Paper # 1. Fly heads: + ♀ w♀ ♀we ♀wa ♀wa / w ♀ we / wa.
Papel # 2. Cuerpos de cabezas de moscas colocadas en papel # 1.
Papel n. ° 3. Cabezas de vuelo: + ♀ w♀ ♂w ♀Cu ♀bw ♀Cu / bw.
Papel n. ° 4: el cuerpo de las cabezas de la mosca colocadas en el papel n. ° 3.
Después de la siembra, colocamos los papeles en los baldes que contienen el sistema disolvente 20: 3: 7 de alcohol butílico / ácido cetílico glacial / agua destilada. Una vez desarrollada la ejecución de la cromatografía, los documentos se visualizaron utilizando un visor de luz ultravioleta.
Cromatografía de pigmentos oculares:
En los especímenes de D.melanogaster salvaje, la pigmentación de los ojos se debe a la presencia de dos tipos de pigmentos: pteridinas y ommocromos; los primeros son compuestos de colores brillantes que emiten fluorescencia y emiten una luz de color característica cuando se observan bajo luz ultravioleta. Los ommocromos son marrones y no emiten fluorescencia a la luz ultravioleta. La producción de cada tipo de pigmento implica una secuencia de pasos biosintéticos conocidos. El precursor de las pteridinas es 2-amino-4-hidroxipteridina, mientras que el de las ommocromas es el aminoácido triptófano. Una vez formados, estos pigmentos deben fijarse en los gránulos proteínicos de los ommatidios que forman las facetas de los ojos. El conjunto de estos pigmentos en individuos salvajes hace que los ojos sean rojos. En la fijación de los pigmentos, interviene la actividad de otro gen independiente de aquellos genes relacionados con la biosíntesis. Es el alelo salvaje "blanco", la actividad del gen involucrado en el proceso de fijación de los pigmentos a los gránulos de proteína ommatidium. Por lo tanto, las hembras mutante w / w y el hemigo w / Y machos no pueden fijar los pigmentos oculares, y aunque pueden biosintetizarlos, sus ojos son blancos. Este resultado se refleja en los cromatogramas realizados. Una cepa mutante en una secuencia metabólica determinada, como es el caso de la formación de pigmentos, puede reconocerse porque carece del producto final de la secuencia biosintética, sin embargo, presenta el compuesto que precede al paso biosintético mutado en la secuencia. cromatografía sobre papel y utilizando un sistema de disolventes orgánicos adecuados, fue posible separar los pigmentos en diferentes puntos identificables.
Para una cepa salvaje, la cromatografía de cepas permite la separación de 7 diferentes pteridinas: drosopterina, amarillo dorado; isoxantopterina, púrpura; sepiapterina, amarillo limón; 2-amino-4-hidroxipterina, de color azul; biopterina, azul violeta; xantopterina, color azul-verde e isosepiapterina, amarillo anaranjado. Los mutantes del color de los ojos de D. melanogaster presentan un patrón de pteridina diferente del patrón de la cepa silvestre. Para discernir los fenómenos de interacción alélica, es muy importante establecer el nivel de observación de los individuos en estudio, y así poder establecer la relación de dominio entre un gen y su alelo. En el caso de individuos homólogos (AA o aa), la expresión conjunta de ambos alelos idénticos conduce a la expresión de un fenotipo característico, dominante o recesivo. Los individuos heterocigotos Aa pueden ser fenotípicamente idénticos a los homocípidos de AA dominantes, sin embargo, cuando el análisis fenotípico se realiza en otro nivel de observación, por ejemplo a nivel bioquímico, pueden establecerse las diferencias de fenotipo entre individuos AA y Aa. . El nivel de observación de un individuo heterocigoto puede revelar la actividad o la ausencia de actividad de un gen recesivo. Un análisis de los productos sintetizados por los genes en cuestión, permitirá reconocer la actividad o inactividad oculta del gen alélico recesivo que se enmascara por la presencia del producto genético dominante en el heterocigoto, esto permitirá establecer diferencias entre homólogas y individuos heterocigotos.
Resultados y discusiones.
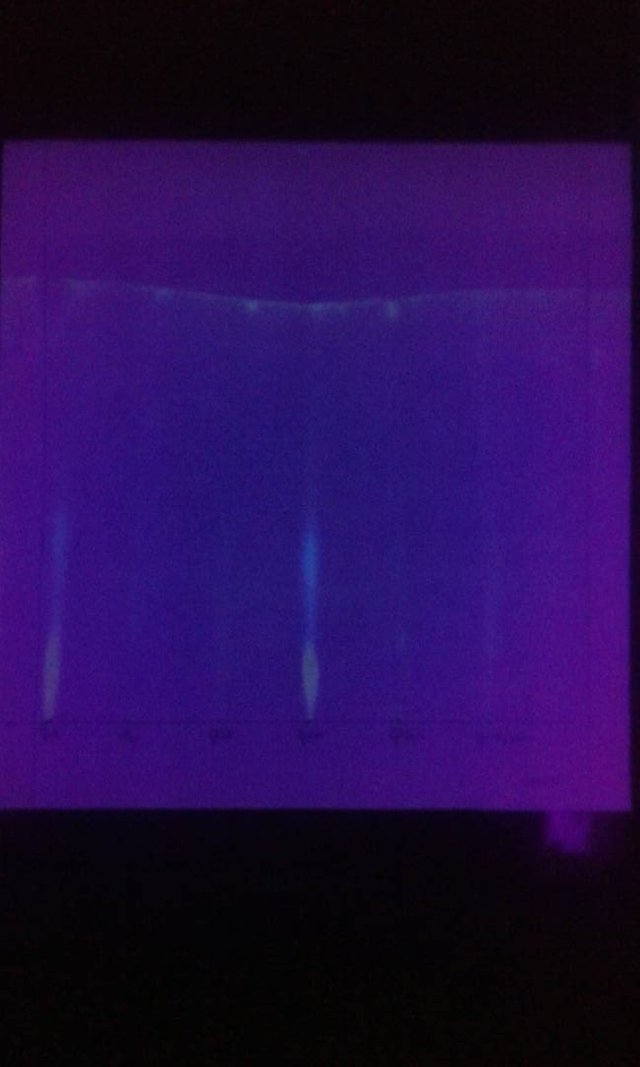
En especímenes de D. melanogaster silvestre, la pigmentación de los ojos se debe a la presencia de dos tipos de pigmentos: pteridinas y ommocromas; los primeros son compuestos de colores brillantes que emiten fluorescencia y emiten una luz de color característica cuando se observan bajo luz ultravioleta. Los ommocromos son marrones y no emiten fluorescencia a la luz ultravioleta. La producción de cada tipo de pigmento implica una secuencia de pasos biosintéticos conocidos. El precursor de las pteridinas es 2-amino-4-hidroxipteridina, mientras que el de las ommocromas es el aminoácido triptófano. Una vez formados, estos pigmentos deben fijarse en los gránulos proteínicos de los ommatidios que forman las facetas de los ojos. El conjunto de estos pigmentos en individuos salvajes hace que los ojos sean rojos. En la fijación de los pigmentos, interviene la actividad de otro gen independiente de aquellos genes relacionados con la biosíntesis. Es el alelo salvaje "blanco", la actividad del gen involucrado en el proceso de fijación de los pigmentos a los gránulos de proteína ommatidium. Por lo tanto, las hembras mutante w / w y el hemigo w / Y machos no pueden fijar los pigmentos oculares, y aunque pueden biosintetizarlos, sus ojos son blancos. Este resultado se refleja en los cromatogramas realizados (figura 5). Una cepa mutante en una secuencia metabólica determinada, como es el caso de la formación de pigmentos, puede reconocerse porque carece del producto final de la secuencia biosintética, sin embargo, presenta el compuesto que precede al paso biosintético mutado en la secuencia.
Mediante cromatografía en papel y utilizando un sistema de disolventes orgánicos adecuados, fue posible separar los pigmentos en diferentes puntos identificables. Para una variedad de moscas silvestres, la cromatografía permite la separación de 7 diferentes pteridinas: drosopterina, amarillo dorado; isoxantopterina, púrpura; sepiapterina, amarillo limón; 2-amino-4-hidroxipterina, de color azul; biopterina, azul violeta; xantopterina, color azul-verde e isosepiapterina, amarillo anaranjado. Los mutantes del color de los ojos de D. melanogaster presentan un patrón de pteridina diferente del patrón de la cepa silvestre. Para discernir los fenómenos de interacción alélica, es muy importante establecer el nivel de observación de los individuos en estudio, y así poder establecer la relación de dominio entre un gen y su alelo. En el caso de individuos homólogos (AA o aa), la expresión conjunta de ambos alelos idénticos conduce a la expresión de un fenotipo característico, dominante o recesivo. Los individuos heterocigotos Aa pueden ser fenotípicamente idénticos a los homocípidos de AA dominantes, sin embargo, cuando el análisis fenotípico se realiza en otro nivel de observación, por ejemplo a nivel bioquímico, pueden establecerse las diferencias de fenotipo entre individuos AA y Aa. . El nivel de observación de un individuo heterocigoto puede revelar la actividad o la ausencia de actividad de un gen recesivo. Un análisis de los productos sintetizados por los genes en cuestión, permitirá reconocer la actividad o inactividad oculta del gen alélico recesivo que se enmascara por la presencia del producto del gen dominante en el heterocigoto, esto permitirá establecer diferencias entre individuos homólogos y heterocigotos.
Conclusiones.
Fue posible obtener una cromatografía del patrón de pteridina de cepas normales y mutantes de D. melanogaster.
Se evidenciaron diferencias en los patrones de pteridina de las diferentes cepas mutantes. También hubo variaciones entre sexos.
Se establecieron diferencias a nivel bioquímico entre individuos homólogos y heterocigotos.
Anexos.


Referencias
• Anthony Griffiths 2008. Genética. Interamericano McGraw-Hill de España. S.A.U. 9ª edición. Madrid. España.
• William Klug, 2013. Conceptos de Genética. Pearson Education, S.A. 10ª edición. Madrid.
• Daniel, Wayne W. 2009 Bioestadística. Editorial Limusa, S.A. 4ª edición. Méjico.
• Unidad de enseñanza de genética. Guía del Laboratorio de Genética General del Departamento de Biología Celular. Unidad Central de Venezuela.
Espero que les haya gustado esta publicación, gracias por visitar mi publicación.
Trabajo realizado en la Universidad Central de Venezuela por @Norihany. Las fotografías se tomaron con un teléfono Samsung s4 por @Norihany.
Alguna parte del mundo.

Excelente publicación.
GraciasMuchas gracias por el apoyo... me encanta ese gif de @Don.quijote. Saludos.excelente post!, muchos saludos yque sigan los éxitos
Muchas gracias¡Bravo! Muy interesante tu post
Gracias