MICROTECNIA VEGETAL // Técnicas y caracterizaciones morfoanatómicas
¡Saludos estimados amigos, seguidores e integrantes! de la plataforma Steem.
Sirva este post, para incorporar una nueva temática de publicación titulada; MICROTECNIA VEGETAL, segmento que persigue socializar con toda la comunidad académica de la red social Steemit, las diferentes técnicas empleadas en la preparación de micro-muestras vegetales, destinadas a estudios de caracterización anatómica y morfológica, en esta oportunidad abordaremos lo relacionado a los principales procedimientos utilizados, por la microscopía óptica a nivel de laboratorio.
El post se presenta, bajo la premisa de socializar imágenes procedimentales sobre microtecnia vegetal, esperando sea de gran aporte académico, y del agrado de todos los miembros de nuestra comunidad #stem-espanol.
Introducción
Los estudios histológicos del área vegetal, representan una práctica recurrente en las investigaciones botánicas, esto porque, permiten caracterizar las estructuras microscópicas a nivel de tejidos, y relacionar la representación morfológica, con la funcionalidad de cada grupo histológico, de allí que, existan diferentes procedimientos específicos para la preparación de muestras vegetales, además de métodos de observación microscópica, que admiten determinar la diferenciación de los tejidos vegetales .
Ahora bien, al conjunto de procedimientos aplicados para caracterizar las estructuras microscópicas a nivel de tejidos vegetales, se denomina Microtecnia vegetal, esta área de la histología botánica, tiene por finalidad preparar y conferir condiciones óptimas a las micro-muestras vegetales, con el objeto de poder observar, examinar y analizar en detalle los componentes morfológicos y anatómicos, mediante técnicas especificas de microscopía [5].
En atención a estas consideraciones, el objetivo del presente post persigue socializar los principales procedimientos técnicos, utilizados para realizar caracterizaciones morfoanatómicas en micro-muestras vegetales, complementando para ello, determinaciones a nivel de laboratorio.
Histología vegetal
El área de la botánica, que se encarga del estudio minucioso de los tejidos vegetales se llama histología vegetal, disciplina científica enfocada primordialmente en la identificación estructural y morfológica, de cada conjunto de células biológicamente constituido, y con ello poder deducir, comprender y analizar las funciones de los tejidos vegetales resultantes de estas asociaciones, además de su relación con cada estructura organográfica [1].
Microtecnia vegetal
Dentro de la histología vegetal, al conjunto de procedimientos aplicados para caracterizar las estructuras morfoanatómicas de micro-muestras vegetales, se le conoce como microtecnia vegetal, cuyo propósito consiste en observar con especificación y detalle los tejidos vegetales, determinando los cambios morfogénicos desde la aparición del cigoto, conformación de estructuras organográficas especializadas y la senescencia de estas [5].
Los procedimientos aplicados para caracterizar las estructuras morfoanatómicas de micro-muestras vegetales, a saber son; cortes histológicos, coloración histológica, preparación de micro-muestras vegetales, montajes histológicos y observación.
Cortes histológicos
Se entiende, por corte histológico a la fracción delgada, o parte organográfica de una especie vegetal que ha sido seccionada, con el objetivo de describirla anatómica y morfológicamente, detallando sus células y tejidos, dentro de las técnicas histológicas utilizadas, se encuentran las siguientes; a) Corte mecánico (uso de micrótomos), b) Corte a mano alzada.
Cortes con micrótomos
Los cortes histológicos, efectuados con micrótomos son de gran precisión, básicamente porque, estos modernos dispositivos logran dividir las micro-muestras vegetales, en rebanadas muy delgadas, con precisión estructural y en secciones que pueden oscilar entre 1 y 50 micras, esto de acuerdo a la capacidad del instrumento y objetivo de investigación [1] y [5].

Imagen 2. Micrótomo. Dominio público - créditos
Cortes a mano alzada
Es importante indicar, que dentro de la enseñanza de la botánica histológica, el corte más empleado en las prácticas de laboratorio, es precisamente el de mano alzada, esta convencional técnica consiste en sostener el material vegetal entre los dedos pulgar e índice de una mano, haciendo descansar la navaja, hojilla o bisturí en una de las esquinas del dedo índice de la otra mano, y manteniendo los brazos fijos, lo más cercano posible al cuerpo, cabe destacar, que los cortes se hacen en dirección al cuerpo, y el número de cortes deben ser suficientes, esto con la finalidad de seleccionar las más delgados.
Orientación de los cortes histológicos
La orientación que se tomé, para realizar la división de micro-muestras vegetales, responde en gran medida a la finalidad de caracterización morfoanatómica del espécimen sujeto a evaluación, ahora bien, las orientaciones de cortes histológicos ampliamente utilizadas dentro de las observaciones, mediante microscopios ópticos, son las siguientes;
A. Corte transversal
Este corte histológico, se realiza perpendicularmente a un eje imaginario que atraviesa la muestra, dividiéndose la micro-muestra vegetal, en una sección anterior y otra posterior, también llamada basal.
B. Corte longitudinal
La orientación del corte longitudinal, se realiza de forma paralela al eje imaginario que atraviesa la micro-muestra vegetal, separándose una región dorsal de la ventral.
C. Corte tangencial
No se trata de un corte histológico propiamente dicho, pues realmente el procedimiento consiste, en retirar una fracción tangencialmente al eje de la micro-muestra vegetal.

Imagen 3. Corte tangencial en láminas foliares de Eichhornia crassipes. Autor: @lupafilotaxia.
Coloración histológica
En la microtecnia vegetal, al proceso mediante el cual la micro-muestra vegetal, es teñida por una sustancia llamada colorante, se le conoce como coloración histológica, es necesario indicar, que existen distintos tipos de colorantes, sin embargo los más utilizados en botánica son;

Imagen 4. Colorantes empleados en el laboratorio de Botánica agrícola de la UNESUR. Autor: @lupafilotaxia.
1. Safranina
La safranina, es un colorante básico, muy usado en la histología vegetal, pues permite teñir estructuras celulares lignificadas, cutinizadas, suberificadas y quitinizadas, también lograr colorear cromosomas y núcleos.
2. Floroglucina
Este colorante orgánico, se usa para teñir paredes celulares lignificadas, por lo que se utiliza en aquellos tejidos que presentan; xilema y esclerénquima.
3. Lugol
El lugol, es un compuesto que se obtiene de la disolución de yodo molecular y yoduro potásico, se utiliza de forma común para el reconocimiento de gránulos de almidón, sustancia que reaccionan químicamente con el lugol, tomando una coloración azul-morada.
4. Sudan III
El colorante Sudan III, es el compuesto más utilizado en la histología vegetal para colorear cutina y suberina, fundamentalmente por su capacidad de reaccionar con sustancias lipídicas.
Preparación de micro-muestras vegetales
Existen diferentes métodos implicados en el estudio de micro-muestras vegetales, siendo la microscopía óptica, una de las técnicas más empleadas en la observación detallada, estructural y morfoanatómica de los tejidos vegetales, mientras que los procesos involucrados en la preparación del material, pueden desarrollarse por separado, o de forma combinada e histológicamente se les identifica como:
A. Fijación
En histología vegetal, se conoce por fijación, al procedimiento ejecutado con el objetivo de lograr detener los procesos metabólicos a nivel celular, o en otras palabras no tan técnicas, simplemente matar las células tan rápidamente como sea posible, impidiendo de forma simultánea posibles modificaciones morfológicas, es decir, que el fin último del procedimiento consiste en lograr estabilizar los componentes celulares.
En la búsqueda de lograr estabilizar los componentes celulares, generalmente se emplean sustancias o mezclas de sustancias fijadoras, afines al espécimen o calidad de las micro-muestras vegetales (Por ejemplo; las plantas vasculares, musgos y algunas hepáticas, pueden ser fijadas en Alcohol 70%, o en Formol – Alcohol – Acido Acético), por otro lado, es recomendable utilizar dos tipos de fijadores, esto para poder lograr una buena fijación, independientemente al tamaño de la muestra y de su resistencia a la infiltración.
Tipos de fijadores
De acuerdo, a los componentes del fijador pueden actuar dos tipos;
1.- Ácidos, caracterizada por preservar de forma optima la cromatina, nucléolos y el huso mitótico.
2.- Básicos, cuya especificidad preserva bien los núcleos, el nucleoplasma, las mitocondrias y las vacuolas.
B. Endurecimiento
Este procedimiento se ejecuta, con el objetivo de conferirle a las micro-muestras vegetales resistencia, esencialmente para poder seccionarlas, bien sea, mediante el uso de navajas, bisturíes o micrótomos, siendo la parafina, una de las principales sustancias utilizadas para endurecer el material, que será observado con el microscopio óptico, mientras que, las sustancias a base de resinas, se utilizan en aquellos caso dónde las observaciones se realicen empleando microscopios electrónicos.
C. Preservación
Preservar micro-muestras vegetales, implica utilizar sustancias preservadoras como el Alcohol al 70%, o en su defecto Formol – Alcohol – Acido Acético, esto para evitar la aparición de moho (estructuras filamentosas de los hongos) y podredumbre del material vegetal sujeto a estudio.
Montajes histológicos
Luego de desarrollar, todos los procedimientos anteriormente descritos, se procede a ejecutar el montaje, técnica que permite, conservar las estructuras durante minutos, horas o incluso años, en este apartado, es importante mencionar que el éxito de cualquier montaje, antes de llevarlo al microscopio óptico para su observación y determinación, se caracteriza por limpiar el porta objeto, depositar una gota de agua destilada, colocar la micro-muestra vegetal, revestirla con un cubre objeto.
La optimización de toda técnica de montaje, depende invariablemente al tipo de preparaciones, bien sea, temporal o permanente.
A. Preparaciones temporales
La preparación temporal, es una técnica histológica muy sencilla, esto porque, en el momento de su ejecución, no se requiere detener los procesos metabólicos de la micro-muestra vegetal, es decir, no es necesario utilizar sustancias fijadoras, endurecedoras, como tampoco preservadoras.

Imagen 5. Montaje temporal de micro-muestras vegetales, de laminas foliares de Limnocharis flava,. Autor: @lupafilotaxia.
B. Preparaciones permanentes
Las preparaciones permanentes, son utilizadas en aquellos casos, donde las determinaciones morfoanatómicas puedan ser estudiadas a posterior, es por ello, que se requiere previamente fijar, endurecer y preservar la micro-muestra vegetal con técnicas de cortes y tinciones especiales.
Estudio morfo-anatómico
Con el objeto de ejemplificar, parte del contenido socializado sobre microtecnia vegetal, se desarrollaron descripciones estructurales y morfo-anatómicas, mediante métodos de microscopía óptica, utilizando para ello, el laboratorio de Botánica de la UNESUR.
Procesamiento de micro-muestras vegetales
A efectos del presente post, se consideraron para el estudio, 03 (tres) micro-muestras vegetales, previamente determinadas de láminas foliares de Eichhornia crassipes, Limnocharis flava, y de raíces adventicias de la especie Tradescantia spathacea, el procedimiento seleccionado fue; Preparación temporal, que consistió en: colocar una gota de agua destilada sobre un porta objeto, ubicar la muestra a observar sobre la gota de agua destilada, colocar sobre la muestra un cubre objeto, y por ultimo retirar el agua sobrante con papel absorbente.
Observación y orientación histológica
Cada segmento histológico considerado, provenía de micro-muestras vegetales previamente identificadas, basadas en Seccionamientos transversales y tangenciales a mano alzada, mientras que las observaciones realizadas, se hicieron en microscopios ópticos marca OPTIKA, con la finalidad de determinar cada fracción, mediante enfoques histológicos primero a 4x y luego a 10x.
Resultados morfo-anatómicos
Aún cuando, los seccionamientos histológicos efectuados no se realizaron con la ayuda del micrótomo, los cortes obtenidos mediante la técnica a mano alzada, presentaron segmentos delgados, completos y en rangos aceptables, que permitieron visualizar e identificar, las asociaciones de células en cada una de las micro-muestras vegetales consideradas.
La sección transversal, de la lámina foliar de E. crassipes, mostró (a) epidermis lisa de aspecto rectangular, pared celular delgada, sin tricomas, (b) células parenquimáticas formando filas, y con mayor longitud respecto a las epidérmicas, (c) haz vascular compacto debajo del tejido fundamental, (d) células arenquimáticas redondeadas, entrelazadas y formando anillos que constituyen (e) cámaras de aire (Figura 1).
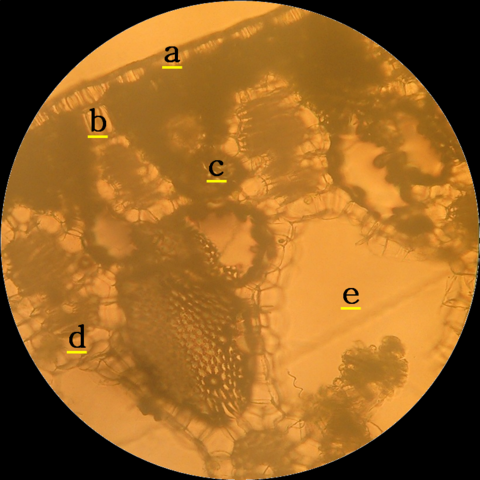
Figura 1. Sección transversal, de lámina foliar de E. crassipes. Autor: @lupafilotaxia.
La estructura morfoanatómica, determinada en la sección tangencial de la lámina foliar de L. flava, mostró (a) pared celular delgada, (b) poro u ostiolo abierto, (c) células oclusivas en estado turgente, (d) células fundamentales ligeramente redondeadas y (e) células acompañantes de geometría hexagonal (Figura 2).

Figura 2. Sección tangencial, de lámina foliar de L. flava. Autor: @lupafilotaxia.
La morfología y anatomía, de raíces adventicias en T. spathacea, mostró (a) células exodérmicas y (b) endodérmicas pequeñas y redondeadas, (c) células floemáticas agrupadas, (d) células xilemáticas formando anillos y (e) células del parénquima medular (Figura 3).
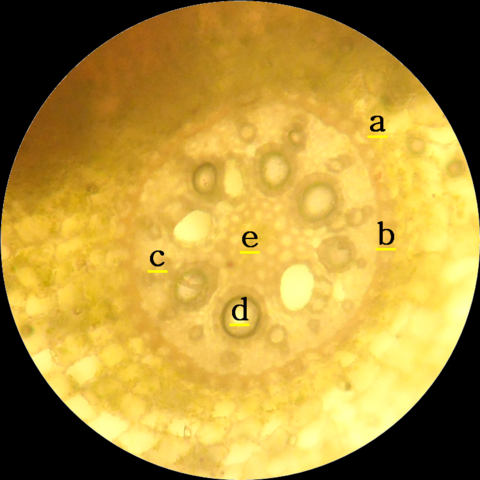
Figura 3. Sección transversal, de raíces adventicias en T. spathacea. Autor: @lupafilotaxia.
APORTES CIENTÍFICOS DE ESTA PUBLICACIÓN
- Las determinaciones estructurales y morfoanatómicas, obtenidas de los seccionamientos histológicos considerados, presentan características difusas, que impidieron la visualización precisa de capas celulares, y el registro de variables morfométricas, sin embargo, los patrones topográficos observados en cada segmento histológico evaluado, permitieron la identificación de asociaciones de células específicas, elemento de utilidad para interpretaciones diagnosticas y taxonómicas, por lo que, se puede señalar que las técnicas histológicas; preparación temporal, seccionamientos transversales y tangenciales, cortes a mano alzada y observación mediante microscopía óptica, podrían considerarse en las comprobaciones experimentales previas, a las caracterizaciones morfoanatómicas con tinción específica, montaje especializado y corte con micrótomo.
REFERENCIAS BIBLIOGRÁFICAS CONSULTADAS Y CITADAS:
[1] Curtis J. Microtecnia Vegetal. 2 ed. Editorial Trillas. México, D. F.1986;106.
[2] Izco J., y Barreno E. Caracteres taxonómicos: Morfología y anatomía de órganos vegetativos. Editorial Edigrafos. Madrid. 2000.
[3] Johri B. Embryology of angiosperms. Springer-Verlag, Berlin. 1984.
[4] Lindorf H. Eco-anatomical wood features of species from a very dry tropical forest. IAWA Journal. 1994;15;4:361- 376.
[5] Roth I. Microtécnica Vegetal. Ediciones de la Biblioteca, U.C.V., Caracas. 1964.
ATENCIÓN / Lectores y Seguidores
Si desean leer más artículos científicos en español, de excelente calidad académica, no pierdan el tiempo, y visiten la etiqueta #stem-espanol, es un proyecto adscrito a la comunidad académica y científica #steemstem, constituido en una gran comunidad hispanohablante que ha crecido a un ritmo acelerado en los últimos meses, con el fin de promover contenido científico en lenguaje español principalmente en las áreas de Ciencia, Tecnología, Ingeniería y Matemáticas.
De la misma manera, es importante indicarles, a todos aquellos amigos e usuarios de Steemit, interesados en publicar artículos en español, usando la etiqueta #stem-espanol, tener presente que:


INVITACIÓN
Amigo lector, si deseas obtener más información al respecto, únase a nuestro servidor en discord
Ahora también puedes seguir a nuestra comunidad en su cuenta Twitter
Ahora también puedes seguir a nuestra comunidad en su cuenta Twitter
twitter.com/EspanolStem

OBSERVACIONES
✔ El POST fue subido 📧📨 utilizando la app oficial de https://www.steemstem.io
Puedes visitar la app oficial de nuestra comunidad principal
https://www.steemstem.io

$rewarding 100% 15 min
Gracias por el apoyo brindado.
Es un placer amigo.
This post has been voted on by the SteemSTEM curation team and voting trail. It is elligible for support from @curie.
If you appreciate the work we are doing, then consider supporting our witness stem.witness. Additional witness support to the curie witness would be appreciated as well.
For additional information please join us on the SteemSTEM discord and to get to know the rest of the community!
With a cordial greeting, to the entire healing team of the SteemSTEM platform, thank you for valuing the content published on: MICROTECNIA VEGETAL // Técnicas y caracterizaciones morfoanatómicas., and for continuing unswervingly supporting scientific academic content.
Curamos la etiqueta #spanish con el token SPACO de la Comunidad de Hispano Hablantes, te invitamos a formar parte de nuestra comunidad.
Extiendo un cordial saludo, a quiénes integran el equipo de curación de la comunidad @sinergica, gracias por valorar el contenido publicado sobre: MICROTECNIA VEGETAL // Técnicas y caracterizaciones morfoanatómicas., y por formar parte de la Comunidad de Hispano Hablantes curando post en la plataforma SPACO.
Gracias.