REACCIONES EN DISOLUCIÓN ACUOSA
Saludos amigos de steemit y de #stem-espanol.

Aspecto de disoluciones acuosas de hidróxido de sodio (izquierda) y sulfato cúprico (derecha). Fuente: @emiliomoron.
Con esta publicación quiero mostrarles algunas propiedades y características de las principales reacciones que se llevan a cabo empleando el agua como solvente.
Reacciones de precipitación
Este es un tipo de reacción química que se caracteriza por la formación de un producto sólido insoluble. Cuando aparece una sustancia insoluble en el agua, las partículas de esta pueden observarse a simple vista en el medio, y con un tiempo de reposo, se depositan en el fondo del recipiente por efecto de la gravedad. A ese compuesto sólido derivado de sustancias previamente disueltas se le conoce como precipitado.
Consideremos el siguiente ejemplo. Cuando mezclamos una solución acuosa de sulfato cúprico (CuSO4) con otra solución acuosa de hidróxido de sodio (NaOH), obtenemos un precipitado de color azul.

Formación del precipitado de hidróxido de cobre II. Fuente: @emiliomoron.
Este compuesto que aparece en la solución como un sólido es el hidróxido de cobre II. Sucede que el sulfato cúprico es un electrólito fuerte, así que en la disolución este se ioniza completamente formando los cationes cobre (Cu+2) y los aniones sulfatos (SO42-); igualmente, el hidróxido de sodio es otro electrólito fuerte, por lo que en su disolución se encuentran dispersos los cationes sodio (Na+) y los aniones hidroxilos (OH-). En el instante del mezclado, la interacción electrostática de estos iones permite la formación del sólido Cu(OH)2, el cual es insoluble. En la solución remanente quedan los iones disueltos Na+ y SO42-, quedan en solución porque el Na2SO4 si es soluble en agua.
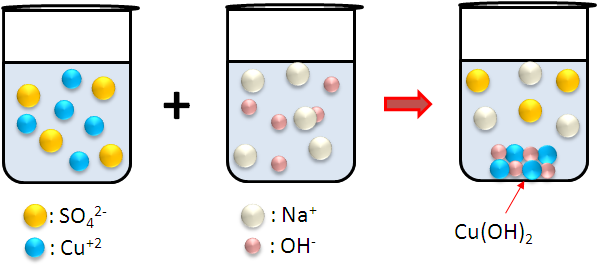
Proceso en el que precipita el hidróxido de cobre II. Fuente: @emiliomoron.
Predicción de la precipitación
La reacción de precipitación está condicionada por un equilibrio iónico, en el cual pueden influir aspectos como la concentración y la naturaleza de las especies que reaccionan, pues no todos los iones son capaces de producir la precipitación.
Entonces, ¿Cómo podemos predecir la formación de un precipitado al mezclar dos soluciones?
Esto depende de la solubilidad del compuesto. “La solubilidad es la máxima cantidad de un soluto que se disolverá en una cantidad dada de disolvente a una temperatura específica”[1]. Coloquialmente solemos decir que una sustancia es soluble si logramos disolver una cantidad apreciable de esta en agua, o decimos que es insoluble si por el contrario no podemos hacerlo.
Si analizamos la mezcla de iones del ejemplo anterior, para predecir la dirección en la que tendrá lugar la reacción debemos comparar los valores del cociente de reacción (Q) y la constante de equilibrio conocida como el producto de solubilidad (Kps). Si mezclamos volúmenes iguales de disoluciones 0,2 M de sulfato de cúprico e hidróxido de sodio, la ecuación global de la reacción es:
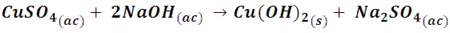
Y la ecuación iónica para la formación del precipitado es:
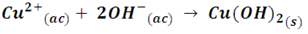
La reacción inversa para esta reacción es el proceso de disolución del Cu(OH)2, en el equilibrio nos quedaría expresado como:
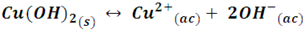
Si Q>Kps para la disolución del Cu(OH)2 entonces la dirección de la reacción es hacia la producción del sólido, por lo que decimos que se formará el precipitado.
El cociente de la reacción Q se calcula a partir de las concentraciones de los iones en la disolución, así, al mezclar 10 mL de cada uno se tiene una solución con un volumen total de 20 mL, por lo cual se obtiene:
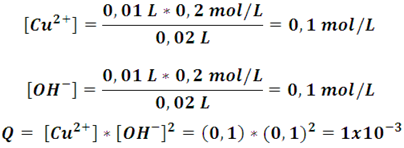
A 25 ºC se tiene establecido que la constante de equilibrio para esta reacción es 1,6x10-19[2], por lo tanto, el valor de Q para estas condiciones es considerablemente más grande que el de Kps, por lo cual, la reacción tenderá a formar el precipitado. En caso contrario, la tendencia es a permanecer disuelto.
Veamos unos ejemplos de la formación de precipitados en el siguiente video.
Reacciones ácido-base
Ácidos y bases en disolución acuosa
Una de las primeras definiciones útiles para los términos ácido y base fue propuesta por Svante Arrhenius, según la definición de este químico un ácido es una sustancia que contiene hidrógeno y que al reaccionar en agua es capaz de liberar cationes hidrógeno (H+), mientras que las bases son compuestos que producen aniones hidroxilos (OH-) al reaccionar en agua. Tales sustancias se conocen como ácidos y bases de Arrhenius.
Sin embargo una de las definiciones más aceptadas es la aportada por los químicos Thomas Lowry y Johannes Brønsted, según la cual los ácidos son moléculas o iones dadores de protones y las bases son moléculas o iones aceptores de protones[3].
Ácidos y bases fuertes
Las sustancias iónicas que se disuelven en agua pueden ser clasificadas como electrólitos fuertes o débiles según el grado de disociación que presenten en la solución. De igual forma podemos clasificar los ácidos y las bases como fuertes o débiles, según el grado de ionización o protonación. Siendo los ácidos fuertes los que están completamente ionizados, es decir, que cada molécula del ácido ha perdido el protón de su átomo de hidrógeno y una base fuerte aquella que está completamente protonada, es decir que cada especie ha adquirido un protón[3]. Así, un ácido y una base débil estarán parcialmente ionizado o protonados respectivamente.
Reacción de neutralización
La reacción de un ácido y una base en disolución acuosa para formar una sal se conoce como neutralización. De forma general se puede describir el proceso mediante la ecuación:
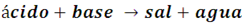
Un ejemplo bastante familiar de este tipo de reacción es la que se produce entre el ácido clorhídrico y el hidróxido de sodio para formar la sal común (NaCl), la reacción implicada es:
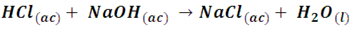
Se han llamado reacciones de neutralización, porque al reaccionar un ácido con una base estas sustancias neutralizan mutuamente sus propiedades. Veamos en el siguiente ejemplo la neutralización del ácido sulfúrico con hidróxido de sodio, compuestos muy empleados a nivel industrial y conocidos por ser sustancias altamente corrosivas.
Como pudieron observar, estas sustancias son un ácido fuerte y una base fuerte, y al cabo de la reacción se neutraliza el caracter ácido y básico de cada una.
Reacciones de óxido-reducción
Estas son el tercer tipo de las principales reacciones en disolución acuosa, también llamadas redox. Para los que han leído con frecuencia mis publicaciones se darán cuenta que son de mis favoritas, sino, pueden revisar publicaciones como obteniendo recubrimientos de color plata y oro o reacciones con permanganato de potasio, donde podrán revisar algunos de los variados y sorprendentes experimentos que podemos realizar con estas reacciones.
La oxidación y reducción
Veamos como ejemplo la reacción entre el hierro y el oxígeno, que quizás es nuestro más claro ejemplo de oxidación:
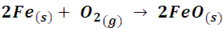
De forma iónica podemos analizar la reacción de la siguiente forma:
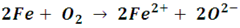
En la misma podemos observar que el hierro pierde electrones, cediéndolos al oxígeno. Bien, este hecho también se puede dar en una disolución acuosa, así el oxígeno no forme parte de la reacción. Tomemos como ejemplo la reacción entre el hierro y el sulfato cúprico en disolución para explicarlo.
La reacción general del proceso se describe como:
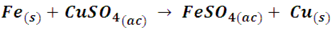
Analicemos las reacciones iónicas por separado:
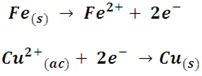
Con estas reacciones podremos notar el mismo comportamiento por parte del hierro, es decir la pérdida de electrones, solo que en este caso son transferidos a otro elemento (el cobre). Así, los químicos reconocemos como oxidación al proceso mediante el cual una especie química sufre la pérdida de electrones.
Pero los electrones no son cosas que se pierden solamente, son partículas que deben migrar a algún sitio, por lo tanto, para que una especie se oxide debe haber otra que gane estos electrones. A este proceso de ganancia de electrones por una especie química se le conoce como reducción. Así, una reacción redox es la combinación de una oxidación y una reducción.
Veamos este proceso con el siguiente experimento. En las imágenes podemos apreciar cómo, al introducir un clavo de hierro en una solución de sulfato de cúprico, al poco tiempo sobre este se forma un deposito rojizo de cobre metálico (sólido), y la solución azul característica del sulfato cúprico se torna verde, color que adquiere por la formación del sulfato de hierro (es decir, el paso de iones hierro a la solución).

Secuencia de imagenes que muestran la reducción del cobre en solución a cobre metálico. Fuente: @emiliomoron.
Aplicaciones de las reacciones en disolución acuosa
Las reacciones aquí mencionadas tienen múltiples aplicaciones.
La precipitación es fundamental para la separación de compuestos por cristalización y posterior filtración, una operación que resulta esencial en la síntesis industrial de muchos compuestos. En el análisis químico resulta primordial para la determinación cuantitativa de una sustancia en una muestra, particularmente es la base del análisis gravimétrico. En operaciones de depuración de efluentes se emplean la precipitación para la eliminación de metales pesados del medio. Estas reacciones también nos permiten explicar la formación de incrustaciones en las tuberías producto de la precipitación de sales de magnesio y calcio, lo cual afecta considerablemente muchas operaciones industriales.
Los ácidos y las bases son sustancias muy comunes en nuestro entorno diario, vinagres y bicarbonato, leche de magnesia y destapa cañerías solo por citar algunos ejemplos de sustancias de esta naturaleza que podemos encontrar en el hogar. Jabones y productos cosméticos emplean estas sustancias para su elaboración, y el pH de los mismos debe ajustarse para las condiciones de la piel. Cuando abusamos de ciertas comidas, en nuestro estomago se eleva la acidez de los jugos gástricos, para aliviar este malestar empleamos sustancias básicas conocidas como antiácidos. En la industria las reacciones ácido-base son muy importantes en la síntesis de compuestos, y en los laboratorios son fundamentales para los análisis cuantitativos de muestras. Incluso la acidificación de la lluvia se debe a la disolución de contaminantes como el dióxido de carbono y dióxido de azufre presentes en el aire por la combustión de combustibles fósiles.
Las reacciones de óxido-reducción también están presentes en una gran cantidad de procesos. Este tipo de reacción encontró un campo de aplicación muy especial, la generación de energía eléctrica, es gracias a este tipo de reacciones que tenemos disponibles pilas o baterías químicas (celdas electroquímicas) para radios, lamparas, celulares, juguetes, entre otros ; igualmente con el proceso inverso, aplicar energía eléctrica a las soluciones, podemos obtener recubrimientos metálicos para la protección de superficies contra la corrosión o para el embellecimiento de una prenda. También son ampliamente utilizadas para purificar electroquímicamente metales y otras sustancias, por ejemplo, mediante la electrólisis de una disolución acuosa de cloruro de sodio se pueden obtener hidrógeno y cloro gaseoso, además de una solución de hidróxido de sodio, esta es una operación de importancia industrial, ya que permite obtener estas tres sustancias de forma más económica que otros métodos.
Referencias
- Chang, R. Química general. Editorial Mc-Graw Gill.
- Whiten, K.W., Gailey, K.D. Química general. Editorial Interamericana.
- Atkins, P., Jones, L. Principios de química. Editorial Panamericana.
- Wikipedia.com. Reacción ácido-base
Esta genial el experimento del calvo.
Saludos Breili, gracias por pasar a leer. Estas reacciones son muy particulares!
This post has been voted on by the SteemSTEM curation team and voting trail in collaboration with @utopian-io and @curie.
If you appreciate the work we are doing then consider voting all three projects for witness by selecting stem.witness, utopian-io and curie!
For additional information please join us on the SteemSTEM discord and to get to know the rest of the community!
thank you very much!
Hi @emiliomoron!
Your post was upvoted by Utopian.io in cooperation with @steemstem - supporting knowledge, innovation and technological advancement on the Steem Blockchain.
Contribute to Open Source with utopian.io
Learn how to contribute on our website and join the new open source economy.
Want to chat? Join the Utopian Community on Discord https://discord.gg/h52nFrV
Contenido muy bien redactado y bastante detallado con una explicación experimental simple pero super genial...Gracias por tu aporte a la comunidad Emilio
Saludos amigo. Muchas gracias por tu apreciación y gracias a ti y a la comunidad por el constante apoyo! espero seguir aportando para su crecimiento.
Congratulations @emiliomoron! You have completed the following achievement on the Steem blockchain and have been rewarded with new badge(s) :
Click here to view your Board of Honor
If you no longer want to receive notifications, reply to this comment with the word
STOPDo not miss the last post from @steemitboard:
Cada teoría acompañada de su experimento, sin duda un post muy entretenido y con gran riqueza tanto en contenido, como en recursos visuales. Mayor nivel de excelencia no creo que sea posible.
Saludos @ivymalifred. Muchas gracias por pasar a leer el post y por tan halagador comentario, espero poder seguir compartiendo contenido de este nivel con toda la comunidad!
Excelente trabajo EMilio!
Hola @alexaivytorres, ¿como estas? me alegra que te haya gustado el post, gracias por tu comentario.