Sólidos y Líquidos (Propiedades y Características)
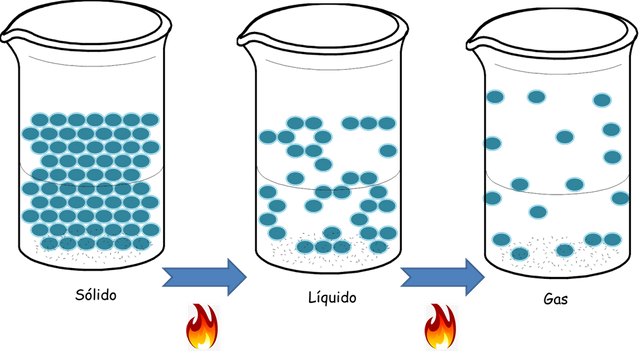
En mi post anterior les mostré las propiedades y características de los gases y también en un post que llamé transformaciones físicas de sustancias químicascomo estos se pueden convertir en líquidos o sólidos con los cambios de la presión y temperatura de los sistemas. Esto sucede porque al bajarle la temperatura a un gas la energía cinética de sus moléculas disminuye. Como consecuencia de la disminución de la velocidad las moléculas tienden a manifestar fuerzas de atracción. En los líquidos las moléculas no son tan libres como en los gases, sino que como presentan más fuerza de atracción pueden moverse de acuerdo a los movimientos de otras esto hace que la entropía del sistema (el desorden caóticos de las moléculas) sea menor.
Los líquidos tienen un volumen establecido pero pueden tener cualquier forma dependiente del recipiente que los contiene, debido a la movilidad de sus moléculas. Esto hace también que la densidad del estado líquido sea mayor que el gaseoso. Para entenderlo mejor, imaginen 1 mL de agua líquida que ocupa un centímetro cuadrado de volumen pero si esta misma cantidad se encuentra en estado gaseoso ocupará un volumen de 4.3x104 mL esto es por la distancia que existe entre cada partícula gaseosa.
En el post que les mencione de los gases les mostré un ejemplo de como un gas se difunde en un gas de forma casi instantánea. Pero en los líquidos este fenómeno es más lento como se muestra en el vídeo siguiente. Donde agrego una gota de tinta en un vaso de agua y se observa como lentamente se difunde el color por el agua, esto es gracias a que las moléculas en los líquidos se encuentran más juntas que en los gases.
Difusión de líquidos en líquidos @VianniS
Como todos saben los sólidos se producen al enfriar los líquidos a muy bajas temperaturas y ellos presentan un volumen y una forma establecida ya que el movimiento de las moléculas en el estado sólido es casi nulo y su densidad por ende aumentará desde el estado líquido al sólido. El estado sólido de cualquier sustancia es incomprensible por lo unido que se encuentran las moléculas una de las otras. Como les mostré en el post de las transformaciones físicas de las sustancias puras, cuando a un sólido se le aplica altas temperatura la energía cinética de cada molécula aumenta y por estas vibraciones se van separando poco a poco cada molécula hasta romper los enlaces que los mantienen como un sólido. Y si se sigue aumentando la temperatura las moléculas se separaran mucho más hasta alcanzar el estado gaseoso. En la figura siguiente podemos observar cómo pasa la difusión de un sólido en otro sólido
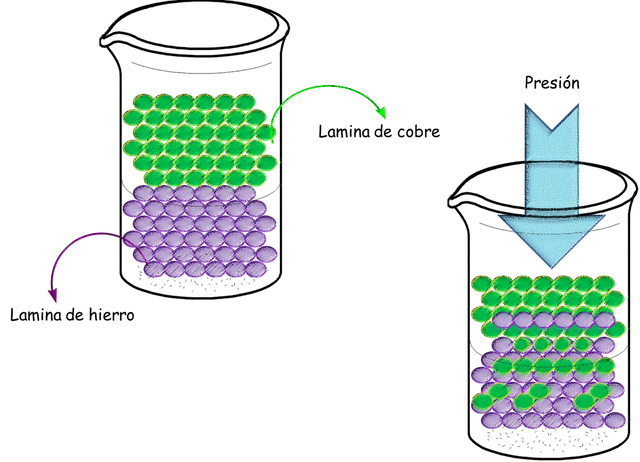
Difusión de sólidos en sólidos. Este proceso lo pueden imaginar si toman dos monedas metálicas y las someten a una presión hidráulica de varias toneladas, las monedas se pegaran.-Fuente: @VianniS
Este fenómeno es muy lento debido al poco espacio que existe entre cada molécula.

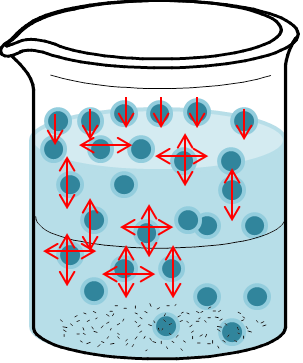
Imaginarnos como las moléculas gaseosas colisionan unas con otras y con las paredes del recipiente es fácil, al igual que saber que las moléculas sólidas están casi rígidas y estáticas. Pero ¿qué sucede en los líquidos? Porque su desorden es mucho mayor que en los solido pero obviamente menor que en los gases. (Ver figura siguiente)
 Estados de la materia -Fuente: @VianniS
Estados de la materia -Fuente: @VianniS Con esta última aclaratoria se pueden definir o establecer algunas de las propiedades de estos sistemas.

El mejor ejemplo es observar como el agua y el aceite no pueden mezclarse, sino que el aceite permanece en la superficie del agua, esto es gracias a la diferencia de densidades entre los dos líquidos. La superficie del agua siempre se comportara como una película que puede soportar cierta cantidad de masa sin hundirse. Si cuidadosamente se coloca una aguja metálica en un recipiente con agua esta se mantendrá a flote por uno momentos hasta que penetre la tensión superficial del agua y se hunda. Pero ¿qué es la tensión superficial? Observa la imagen siguiente donde se muestra un líquido con una serie de moléculas que son atraídas en todas las direcciones excepto las moléculas de la superficie que solo son atraídas hacia abajo por las moléculas cercanas. Esta atracción no está equilibrada del todo por lo que estas partículas se agrupan con más fuerza entre si y el área que existe entre cada una de ellas se reduce al mínimo y crea la llamada película que sostiene la aguja flotando. Esto es lo que se conoce como tensión superficial
Tensión superficial -Fuente: @VianniS

Si los líquidos son sometidos a temperaturas altas aumentara la energía cinética de las moléculas que lo componen. El calor específico es la cantidad de calor que se debe suministrar a un gramo (1 g) de sustancia para que aumente la temperatura en un grado centígrado (1 °C), las unidades de esta magnitud esta dado en energía calórica (calorías/g-grados) Esta es una característica intrínseca de cada liquido debido a las diferentes naturalezas de sus moléculas.
Este valor también muestra la cantidad de energía o calorías que se desprenden de un líquido cuando se enfría un grado centígrado.

Al igual que en los gases, las moléculas de los líquidos tienen diferentes energías de movimiento dependiente de sus posiciones en los recipientes, estas distribuciones de velocidad puede hacer que algunas moléculas rompan la fuerza que las mantiene siendo líquidos y pasen al estado gaseoso en forma de vapor. Esto lo conocemos como evaporación. En caso de encontrarse una superficie impidiendo que las nuevas moléculas escapen del recipiente estas volverán al estado líquido, sino entonces pasaran a la atmósfera y el volumen de la sustancia liquida disminuirá. Para aumentar la velocidad de evaporación de los líquidos, se debe suministrar mayor energía cinética.
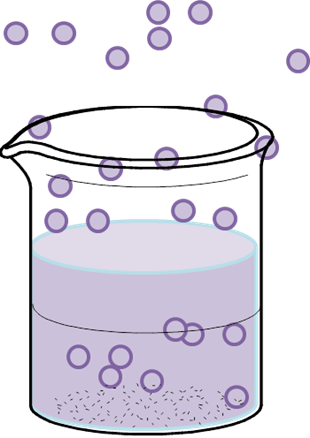
Evaporación de un líquido -Fuente: @VianniS

Cuando un líquido está en reposo en un contenedor cerrado es posible que una poca cantidad de este se evapore pero sin escapar del envase. Las moléculas gaseosas irán aumentando con el paso del tiempo hasta encontrarse más vapor del que puede soportar el recipiente y estas volverán al estado líquido por medio de la condensación al mismo tiempo que ocurre la evaporación creando un equilibrio dinámico en el sistema cerrado. Debido a que las velocidades se igualan la de evaporación y la de condensación el resultado es sin cambios aparentes en la masa y volumen de cada fase. Se llama presión de vapor a la fuerza ejercida por las moléculas gaseosas sobre la superficie del líquido.

Presión de un gas sobre el líquido -Fuente: @VianniS
Para que ocurra la evaporación las partículas liquidas deben sobrepasar la fuerza que las atrae al estado líquido.

Es común ver en un laboratorio de química o física como se recogen gases desplazando agua. Es decir como se muestra en la figura siguiente, en un cilindro graduado invertido con una cantidad de agua, sumergido en un beacker también llego del líquido. Si introducimos una manguera para inyectar aire, este desplazara el agua fuera del cilindro. Y se puede medir la cantidad de aire atrapado. ¿Podemos conocer la presión del gas atrapado en el cilindro?
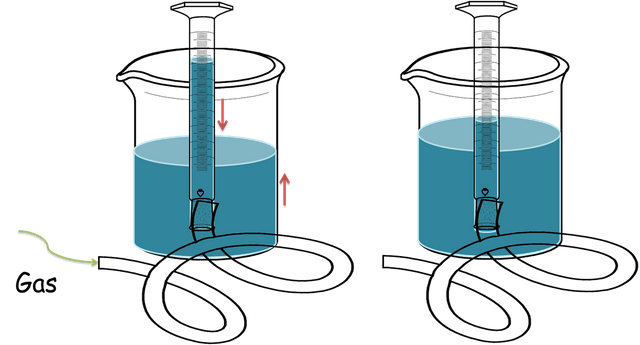
Desplazamiento de agua por un gas -Fuente: @VianniS
Si el instrumento que atrapa el aire esta graduado es posible conocer la presión del gas, por la ley de las presiones parciales que les mostré en el post anterior sabemos que:
Ptotal=P1 + P2 + Pn
PH2O + Pgas = Patm= 745 torr
Entonces conociendo la temperatura del sistema se puede conocer la presión de vapor del agua que se encuentra tabulada en numerosos libros y la presión atmosférica.

La ebullición es el fenómeno donde las moléculas liquidas pasan a ser gaseosas luego de igualarse las presiones de vapor del líquido con la atmosférica. Cuando los líquidos son calentados se forman burbujas de vapor en su interior que van emergiendo hasta la superficie. El valor del punto de ebullición de una sustancia varia con la presión, por ejemplo, el agua ebulle a 100 °C a presión atmosférica (760 torr o 1 atm) pero en un sistema con 355 Torr (0,46 atm) de presión el agua hervirá a 80 °C.

Imagen referencial de la Ebullición. Imagen libre de derechos de autor y disponible para reutilización

Cuando los líquidos pasan a gases las primeras moléculas son las que poseen energía cinética más elevada y para mantener la misma temperatura en la evaporación se debe suministrar esta energía perdida. Pues bien, el calor de vaporización de los líquidos es la cantidad de energía en calorías por gramo que se necesita para mantener la T constante en la ebullición. Existe una relación directa entre esta cantidad y la temperatura. Es decir, cuanto más alta este la T, más energía tienen las moléculas para romper las fuerzas que las atan a ser liquidas


Este es la temperatura a la cual los líquidos dejan de serlo para transformarse en sólidos y llegar al equilibro líquido-sólido. En este estado, la energía cinética de las moléculas es casi nula, es decir, es tan baja que las partículas se encuentran confinadas a un lugar en el espacio específico, sin movimiento aparente. Esta temperatura es la misma que la temperatura de fusión solo que la dirección es la opuesta.

Esto puede sonar algo extraño porque no estamos acostumbrados a ver sólidos que pasen al estado gaseoso muy frecuentemente. Sin embargo, es real, por ejemplo en el hielo seco (CO2) podemos observar como se desprende el vapor directamente del estado sólido. Esto es conocido como sublimación y está relacionado con las fuerzas de atracción entre sus moléculas.

El universo esta sumergido en el complejo caos ordenado. Pues si aunque suena algo raro pensar en un desorden lógico así es la naturaleza. La materia tiende al desorden por medio de los cambios de fases. el ejemplo perfecto es el bióxido de carbono, o hielo seco que es gaseoso en condiciones normales y jamas podrá cambiar al estado solido naturalmente mas sin embargo, cuando esta en solido se evapora con mucha facilidad a bajas temperaturas.
Otro ejemplo natural es como los puentes y estructuras metálicas realizadas por el hombre con mucho esfuerzo con el paso del tiempo y las condiciones ambientales volverán a ser minerales oxidados como se encontraban en un principio antes que fueran procesadas en estas estructuras.
Las estatuas de piedras talladas también son un excelente ejemplo ya que con el tiempo volverán a ver polvo. Esto es por la materia prefiere su naturaleza desordenada y cada sustancia tiene sus propiedades preferentes.
He llegado al final del tema propuesto en este post donde les muestro las propiedades de los otros dos estados de la materia que coexisten en el universo formando un equilibrio perfecto.
Y por supuesto, si aún no perteneces a la comunidad científica de #Stem-espanol y quisieras optar por la curación de contenido te extiendo la invitación a nuestro canal de Discord para que conozcas los criterios y normas establecidos por los curadores de esta comunidad. Pero te adelanto que si tus intensiones son el plagio, la mala ortografía y contenido nada original no tendrás éxito con nosotros. Porque una de las característica de esta comunidad en crecimiento es curar solo contenido de calidad.
Referencias
Si quieres ampliar más tus conocimientos sobre el tema puedes consultar alguno de los siguientes textos de química avanzada.
Frank Brescia, Stanley Mehlman, Frank Pellegrini y Seymour Stambler, Quimica, editorial interamericana,
Raymond Chang, Química, Editorial, McGraw Hill,
Engel Reid, Química Física, editorial Pearson
This post has been voted on by the SteemSTEM curation team and voting trail in collaboration with @utopian-io and @curie.
If you appreciate the work we are doing then consider voting all three projects for witness by selecting stem.witness, utopian-io and curie!
For additional information please join us on the SteemSTEM discord and to get to know the rest of the community!
¡Felicitaciones!
Te participamos que puedes invertir en el PROYECTO ENTROPÍA mediante tu delegación de Steem Power y así comenzar a recibir ganancias de forma semanal transferidas automáticamente a tu monedero todos los lunes. Entra aquí para más información sobre cómo invertir en ENTROPÍA.
Apoya al trail de @Entropia y así podrás ganar recompensas de curación de forma automática. Entra aquí para más información sobre nuestro trail.
Puedes consultar el reporte diario de curación visitando @entropia.
Atentamente
El equipo de curación del PROYECTO ENTROPÍA
Gracias por el apoyo.
Hi @viannis!
Your post was upvoted by Utopian.io in cooperation with @steemstem - supporting knowledge, innovation and technological advancement on the Steem Blockchain.
Contribute to Open Source with utopian.io
Learn how to contribute on our website and join the new open source economy.
Want to chat? Join the Utopian Community on Discord https://discord.gg/h52nFrV
Excelente aporte @viannis, como siempre muy bien explicado con las imagenes. Los líquidos tienen propiedades interesantes, y casos como el agua son exepcionales, y son el medio más empleado para las reacciones químicas, por lo que su comprensión es importante. Saludos amiga.
Saludos querida @viannis excelente material. La química es un mundo fascinante, es un gran deleite poder leer tus post muy bien escritos!
La química en su esplendor tu y emilio realizan un gran trabajo..Encantado de poder tener este tipo de material en la etiqueta muchas gracias por tu aporte
Congratulations @viannis! You have completed the following achievement on the Steem blockchain and have been rewarded with new badge(s) :
Click here to view your Board of Honor
If you no longer want to receive notifications, reply to this comment with the word
STOPDo not miss the last post from @steemitboard: