Sans cet élément, pas de vie sur terre!
Introduction:
(φωσφόρος), mot grec signifie « Porteur de lumière ». D'ici le nom phosphore a été dérivé en raison de la possibilité d'auto-inflammation de l'exposition à l'air.
Le phosphore est un élément chimique de symbole P. il entre dans la synthèse de toutes les cellules vivantes, donc c'est très important et la vie sans phosphore est impossible. Il représente également 0,13 pour cent de la composition de la croûte terrestre mais il n'existe jamais dans un état pur en raison de sa grande activité chimique, mais il est présent avec d'autres éléments sous la forme de composés chimiques le plus important d'entre eux est le phosphate de calcium Ca3(Po4)2.
Le phosphore représente environ 1% du poids du corps et est présent dans chaque cellule, cela montre sa grande importance, il est nécessaire d'effectuer de nombreuses fonctions vitales; les os et les dents contiennent 85% du phosphore présent dans le corps, et c'est le deuxième minéral le plus abondant dans le corps après le calcium.

Pixabay
Dans cet article, nous allons identifier les propriétés du phosphore et ses avantages pour le corps humain et les plantes, ainsi que ses utilisations dans la vie publique et les industries, où il est largement utilisé dans l'industrie en raison de sa grande interaction avec d'autres éléments et de ses propriétés physiques et chimiques.
Mais avant tout, apprenons l'étrange histoire derrière la découverte de cet élément!!!
Le rêve de l'or a conduit à la découverte du phosphore!

Pixabay
Avez-vous déjà entendu parler de la pierre des philosophes?. C'est la pierre légendaire que les gens pensaient à l'époque que l'utiliser pourrait transformer les métaux en or. Et c'est ce qui les a poussés à chercher cette pierre, oui c'est le rêve de l'or. Bien sûr, à notre époque et avec le développement de la science, nous savons tous que cette pierre n'existe pas mais dans l'ancien temps, ce n'était pas si clair.
Comme tous les gens de son temps, le chimiste allemand Hennig Brand a essayé d'obtenir la pierre philosophale, c'est ce qui lui a fait découvrir l'élément du phosphore après avoir essayé d'obtenir la pierre philosophale en chauffant de l'urine dans un milieu ne contenant pas d'air en 1669, il obtient une substance semblable à la cire, brille avec la lumière quand exposé à un peu de chaleur. Cette découverte a causé une grande sensation parmi les gens, les autres chimistes ont essayé d'en savoir plus sur la découverte de Brand, mais il n'a publié sa découverte qu'après une longue période de temps.
Tout le monde pensait que ce que Brand avait découvert était la pierre philosophale, et les grands seigneurs ont essayé d'acheter cette découverte, en raison de son éclat dans le noir, il a été appelé lumière froide, puis appelé le porteur de la lumière.
Après la propagation de la découverte, les chimistes ont continué leurs tentatives d'utiliser du phosphore pour convertir certains matériaux en or, croire que le phosphore est la pierre des philosophes mais toutes leurs tentatives ont échoué et la pierre des philosophes n'a pas montré ses propriétés surnaturelles miraculeuses!. Pour eux, le phosphore reste un élément incompréhensible sans aucune application scientifique.
Le rôle du phosphore n'a été connu que deux siècles plus tard, cela a été fait par le chimiste "Liebig" qui a découvert le rôle du phosphore dans la vie des plantes et cela l'a fait essayer de généraliser l'utilisation des sels phosphoriques pour améliorer la récolte de blé; c'est ce qui a été fait après des années de recherche et de travail sérieux, faisant du phosphore un élément chimique très important dans l'agriculture.
Propriétés génerale:
Le phosphore est un élément chimique présent sous plusieurs formes qui sont similaires en termes de propriétés chimiques et qui ont des propriétés physiques différentes, ses formes les plus courantes sont le blanc, le rouge, le noir et le violet. Il est présent avec les éléments du quinzième groupe dans le tableau périodique.
- Nom: phosphore
- Symbole: P.
- Numéro atomique: Z=15.
- Configuration électronique: 1S2 2S2 2P6 3S2 3P3.
- Masse atomique: 30,974.
- Etat standard: Solide.
- Electronégativité: 2,19.
- Isotopes: 31P, 33P, 32P.
- Energie d'ionisation:
1er= 10,48 e.V
2éme= 19,76 e.V
3éme= 30,20 e.V - Rayon atomique: 98pm.
1)Phosphore blanc P4:
Il est solide et doux comme la cire, il a l'odeur de l'ail lorsqu'il brûle, et c'est un ingrédient très actif qui réagit automatiquement avec le dioxygéne (O2) dans l'air où il rayonne la lumière verte dans l'obscurité et il émet également des vapeurs blanches à la suite de cette réaction, et peut être sauvé pendant des années sous l'eau.
[Self made figure]
- Densité: 1.82.
- Point de fusion: 44.1 °C.
- Degré d'ébullition: 280 °C.
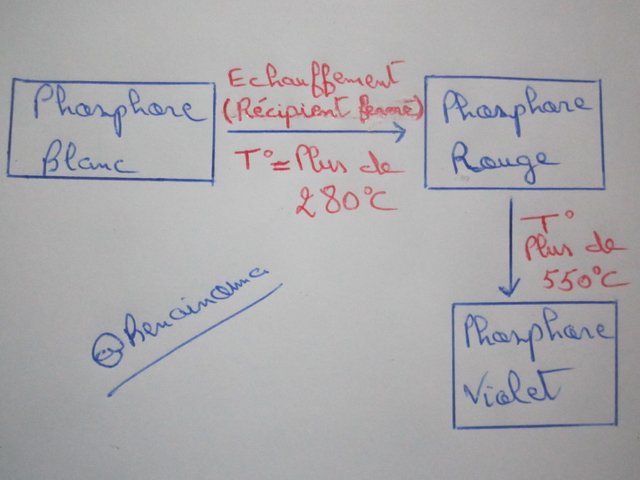
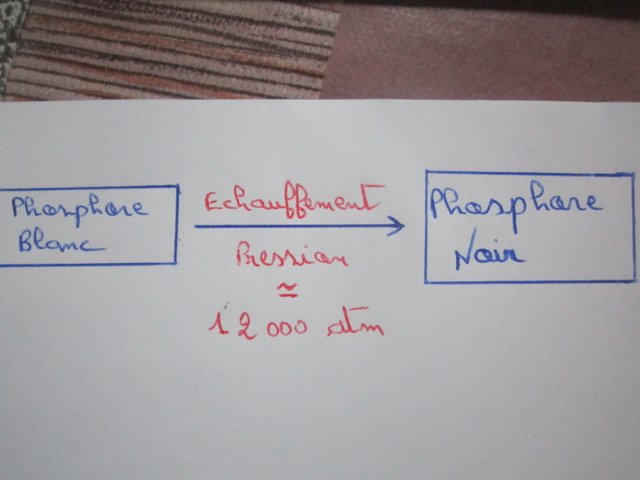
Lorsque le phosphore blanc est chauffé dans un récipient fermé, il se transforme en phosphore rouge, et lorsqu'il est chauffé sous haute pression (pression 12 000 atmosphères), il se transforme en phosphore noir ou en violet.
Le phosphore blanc est également appelé phosphore jaune ou tétraphophore "P4", il est appelé jaune parce que sa couleur devient jaune rapidement lorsqu'il est exposé à l'air. C'est un matériau inflammable, il est également très lent dans la solubilité dans l'eau, donc il est conservé dans l'eau, mais il est soluble dans le benzène et les huiles.
L'équation de la combustion du phosphore blanc dans l'air:
P4 + 5O2 ================ P4O10 (a 50 °C)
P4O10: Pentoxyde de phosphore.
Nous pouvons obtenir de l'acide phosphorique (4H3PO4) à partir d'une interaction du pentoxyde de phosphore (P4O10) avec de l'eau selon l'équation suivante:
P4O10 + 6H2O =============== 4H3PO4
REMARQUE:

Pixabay
Le phosphore blanc est une substance très toxique, car le toucher peut causer de graves brûlures et une dose de 50 mg est considérée comme fatale.
Propriétés physiques du phosphore blanc:
- Masse molaire: 123.895 g/mol.
- Solubilité dans l'eau: 0.003 g/l (a 20 °C).
- Masse volumique: 1.83 g.cm-3.
- Point d'éclaire: 30 °C.
- Température d'auto-inflammation: 30 °C.
Réaction du phosphore blanc avec l'acide sulfurique et l'acide azoté forme de l'acide phosphorique selon les équations suivantes:
2P+ 5H2SO4================ 2H3PO4+ 5SO2+ 2H2O
3P+ 5HNO3+ 2H2O=============== 3H3PO4+ 5NO
La réaction du phosphore avec les métaux forme des les phosphure de métal approbation du métal réactif, par exemple:
3Ca+ 2P============ Ca3P2
Ca3P2 "phosphure de calcium":
Masse molaire : 182,18 g/mol
Masse volumique : 2,51 g/cm³
3Mg+ 2P============== Mg3P2 (phosphure de magnésium)
D'où vient le phosphore blanc?
Le phosphore blanc n'existe pas à l'état libre de la nature, mais se trouve sous la forme de composés dans la croûte terrestre, plus particulièrement le phosphate de calcium, pur ou mélangé avec du chlore ou du fluorure de calcium:
- 3Ca(PO4)2.Ca(OH)2 [Hydroxyapatite]
- Ca3(PO4)2.(CaF)2 [Fluorapatite]
- Ca3(PO4)2.(CaCl)2 [Chlorapatite]
Préparation du phosphore blanc:
Le phosphore blanc est obtenu la plupart du temps par la réaction de réduction du Chlorapatite (trouvé dans la nature) dans le charbon avec la présence de sable concassé (pour former le silicate de métal), ce processus est effectué dans une unité industrielle, qui est un four qu'il a des parois de fer et son sol de charbon ou de béton, le rayon de ce four varie de huit à dix mètres, et l'eau est utilisée pour refroidir ses parois. Ce procédé est effectué à une température comprise entre 1400 et 1450 ° C selon l'équation suivante:
3ِCa(PO4)2+ 6SiO2+ 10C=================== 6CaSiO3+ P4+ 10C
2)Le phosphore rouge:
[Self made figure]
Le phosphore rouge se forme lorsque le phosphore blanc est chauffé à 280 ° C et plus dans un récipient fermé isolé de l'air. Ce procédé se fait par l'effet de la lumière mais c'est très lent et pour accélérer il est préparé au milieu d'un bain de métal (mélange de plomb et d'étain).
La densité du phosphore rouge est égale a 2.2 et son point d'ébullition est de 592 °C, il est inodore, non toxique et a peu d'activité chimique contrairement au phosphore blanc.
- Le phosphore rouge ne brille pas dans l'obscurité et ne se combine pas avec le soufre et les halogènes
3)Le phosphore noir:
[Self made figure]
Nous obtenons du phosphore noir en chauffant du phosphore blanc à 380 ° C sous haute pression (12 000 atm) en présence de mercure. Le phosphore noir est caractérisé par certaines propriétés métallique, où il est caractérisé par la transmission du courant électrique.
Utilisations industrielles du phosphore:
Le phosphore est utilisé dans de nombreux domaines industriels pour fabriquer beaucoup de choses que nous utilisons dans nos vies:
- Photographie.
- Préparations médicales.
- Fumigénes.
- Réactifs chimiques.
- Engrais.
- Allumettes.
- Matiéres plastiques.
- Fusées de signalisation.
- Projectiles incendiaires.
« sans phosphore, la démographie mondiale est menacée car La fin du phosphore menace l'agriculture mondiale»
En agriculture, le phosphore est un élément essentiel où il est utilisé pour la fabrication d'engrais agricoles tels que les superphosphates, qui sont considérés comme des engrais chimiques importants dans l'agriculture.

Pixabay
Le superphosphate est produit en grandes quantités et est largement reçu par les agriculteurs en raison de son prix raisonnable et des grands avantages pour les plantes.
Le phosphore blanc est également utilisé dans la fabrication de bombes incendiaires, ce qui est également un facteur efficace dans la production de fumée épaisse, qui obscurcit la vision et est fréquemment utilisé dans les guerres.
Par conséquent, le phosphore est largement utilisé dans l'industrie militaire.

Pixabay
Le phosphore blanc est la composante la plus importante des bombes destructrices au phosphore qui sont utilisés dans les guerres pour provoquer des incendies pour évacuer les zones et allumer le champ de bataille la nuit, en distinguant les cibles. Et ces bombes ont causé beaucoup de pertes humaines.
Ces bombes ont été utilisées depuis la Première Guerre mondiale, et ont également été utilisées dans la guerre du Vietnam et dans l'invasion de l'Iraq.
Les phosphates sont largement utilisés dans les industries métallurgiques, par exemple, les carrosseries de voitures sont immergées dans une solution de phosphate avant d'être peintes.

Pixabay
Ceci est fait dans le but de former une couche mince de phosphate à la surface du métal, cette couche aide à prévenir la corrosion.
- Le phosphate est également utilisé dans la fabrication de dentifrice et de matériaux de polissage.
Le phosphore est un élément essentiel dans la fabrication des gaz neurotoxiques, ces gaz sont très dangereux et agissent rapidement et souvent conduire à la mort en quelques minutes, car ils sont absorbés par la peau et affectent le système nerveux central.

Pixabay
Il existe des composés chimiques similaires mais moins efficaces, ils sont donc utilisés comme pesticides pour éliminer les insectes et les rats.
Le phosphore est utilisé dans la fabrication du triphosphate de sodium, qui est l'un des composés importants dans l'industrie des détergents.

Pixabay
Mais il y a un seul problème: le triphosphate accélère la croissance et la multiplication des algues dans les égouts d'eau.
De nombreux composés chimiques de phosphore sont utilisés dans l'industrie de la levure.
Pixabay
- Le triphosphate de calcium est également utilisé dans la fabrication de médicaments et de cosmétiques.
Les sels phosphatés sont également utilisés dans la fabrication de produits ignifuges, de verre, de porcelaine et de peinture.

Pixabay
Le verre au phosphate est plus résistant aux rayures que le verre de silice ordinaire et le verre au phosphate permet de passer une plus grande quantité de rayonnement ultraviolet.
- Le phosphore noir, l'avenir de l'industrie électronique:
Le magazine "Nature Photonics" a publié un article scientifique a propos de la recherche effectuée par des chercheurs d'une université américaine. Ils ont conçu un circuit optique au niveau nanométrique en installant une fine couche de phosphore noir (20 atomes).
Les chercheurs ont noté que l'utilisation du phosphore noir a aidé à déplacer plus d'informations et à circuler très rapidement.

Pixabay
Les chercheurs ont déclaré que l'utilisation du phosphore noir dans les communications à haute vitesse et l'industrie informatique pourrait être très efficace si la technologie est améliorée et exploitée.
L'efficacité du phosphore noir était meilleure que le germanium, le premier matériau utilisé dans la détection optique.
L'importance du phosphore pour le corps humain:
Pixabay
Après le calcium, le phosphore est le deuxième minéral le plus abondant dans le corps humain, représentant 1 pour cent de son poids total, et 85 pour cent de celui-ci est présent dans les os et les dents, il existe aussi dans chaque cellule du corps. Le rapport du phosphore normal varie de 4 à 7 milligrammes par litre dans le sang.
- Le phosphore a une grande importance dans la performance du corps de ses fonctions vitales:
- Le phosphore joue un rôle important dans la construction des os et des dents.
- Le phosphore aide à réguler et stocker l'énergie dans le corps, en raison de son rôle important dans le processus de démantèlement des protéines, des glucides. Il aide également à la synthèse de ATP, cette molécule est utilisé dans le corps pour stocker l'énergie.
- Le phosphore aide à maintenir l'acidité du sang.
- Les composés phosphorés aident à la synthèse des acides nucléiques et entrent dans la composition de toutes les cellules du corps sans exception.
- Le phosphore aide à filtrer les déchets dans les reins.
- Le phosphore aide à la contraction musculaire.
- Le phosphore aide à réguler le rythme cardiaque.
Besoins quotidiens :
Selon l'Institut Linus Pauling, les doses quotidiennes recommandées sont les suivantes:
- Nourrisson de 0 à 6 mois: 100 mg/jour
- Nourrisson de 7-18 mois: 275 mg/jour
- Enfants 1-3 ans: 460 mg/jour
- Enfants de 4-8 ans: 500 mg/jour
- De 9 à 18 ans: 1250 mg/jour
- Adultes de 19 ans et plus: 700 mg/jour
Aliments riches en phosphore:

Pixabay
Le phosphore est souvent trouvé riche en aliments qui contiennent un pourcentage élevé de calcium, et la carence en phosphore est très rare en raison de sa grande disponibilité dans les aliments. Les aliments protéinés contiennent de bonnes proportions de phosphore et en sont une bonne source, qu'elle soit animale ou végétale, Ceux-ci incluent:
- La viande
- Les volailles
- Les poissons
- Le lait et ses dérivés
- Les noix
- Les haricots
- Les oeufs
Réferences:
Allotropie du phosphore, Wikipedia
Phosphore rouge, Wikipedia
Phosphore blanc, wikipedia
Phosphore, wikipedia
Phosphorus_15.Tarek_Kakhia.pdf
سلسلة العناصر المعدنية - الفوسفور Phosphorus
La géochimie récréative,livre de G.Fersman, page 119.
Chers steems merci pour la lecture.
Si vous aimez cet article upvoter et suivez Pour être informé des prochains articles.
S'il y a des commentaires, des critiques ou des informations supplémentaires, écrivez-les s'il vous plaît.-
Mes salutations:
@Benainouna
Hi, we have voted on your post because you have posted your article to either food, recipe, recipes, cooking or steemkitchen #tag. Steemkitchen is a brand new initiative where we want to build a community/guild focused purely on the foodie followers and lovers of the steem blockchain. Steemkitchen is out of the conceptual phase and growing each day. We would love to hear your thoughts and ideas.
We are almost ready to Launch the first Decentralized Recipe and Food Blog Website that will utilize the Steem BlockChain and its community to reward contributions by its members.
Please consider joining us at our new discord server https://discord.gg/XE5fYnk
Also please consider joining our curation trail on https://steemauto.com/ to help support each other in this community of food and recipe lovers.
Kind Regards
@steemkitchen
Ps. Please reply “No Vote” if you prefer not to receive this vote and comment in the future.