Espectroscopia Ultravioleta-Visible
Hola amigos continuando con la serie de post sobre la espectroscopia, anteriormente he escrito interesantes publicaciones sobre Raman, espectroscopia de resonancia, espectroscopia confocal, espectroscopia IR, espectroscopia FTIR. En esta oportunidad voy a seguir por la misma línea de publicaciones, es que la espectroscopia es campo muy amplio y tiene muchísimas técnicas de las cuales mostrare hasta que no me falte ninguna por mencionar. Esta técnica es usada particularmente por los químicos en análisis de diversas sustancias y a continuación explicare un breve repaso sobre la misma.
Podemos decir que la espectroscopia ultravioleta-visible es una de las técnicas más usadas en la actualidad, específicamente en el área de la química analítica. Esta técnica básicamente se encarga de estudiar la interacción de la radiación electromagnética con la materia, es decir, se encarga de medir la cantidad de luz absorbida en función de la longitud de onda utilizada.
Dicho esto, la principal función de esta técnica instrumental es identificar por medio de un análisis cualitativo las sustancias químicas y a través de un análisis cuantitativo la concentración del material o sustancia.
Podemos identificar diferentes grupos funcionales de moléculas para poder analizar su contenido, fuerza y concentración de una sustancia, A su vez en el análisis cuantitativo algunos componentes de iones de metales de transición y compuestos orgánicos especialmente aquellos con un alto grado de conjugación.
Se utiliza extensivamente en laboratorios de química y bioquímica para determinar pequeñas cantidades de cierta sustancia, como las trazas de metales en aleaciones o la concentración de cierto medicamento que puede llegar a ciertas partes del cuerpo.
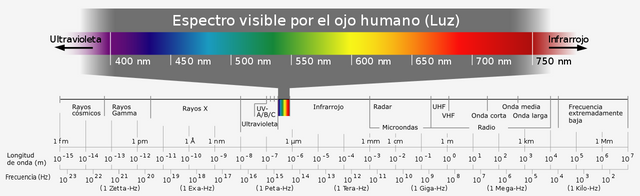
Espectro electromagnético Licencia CC0 3.0 wikipedia de Horst Frank
Todos conocemos el espectro electromagnético y sabemos que el rango de radiación ultravioleta-visible se encuentra entre los rayos X y la luz infrarroja. La radiación ultravioleta está situada en el rango entre 190 y 400 nm, por otro lado, la radiación visible pertenece al rango entre 400 y 800 nm, importante destacar que en esta región del espectro electromagnético la longitud de onda lleva consigo diferentes colores.

Diagrama de absorción de un fotón, donde la energía transmitida debe coincidir entre el estado fundamental y el estado excitado
La absorción de radiación en el espectro ultra-visible está asociado a las transiciones electrónicas de los niveles energéticos de los átomos del material, esto significa que los electrones que los electrones de valencia pueden saltar a otro orbital vacío que tenga mayor nivel energético, esto si se le da la energía adecuada para saltar a ese nivel energético. Todo esto ocurre por la absorción de un fotón, donde la energía transmitida debe coincidir entre el estado fundamental y el estado excitado.
Importante destacar que el tiempo de vida de un átomo excitado por absorción es bastante breve, podemos decir que la energía se disipa cuando el electrón regresa a su nivel fundamental, a esto se le denomina _proceso de relajación. Estos procesos de relajación pueden ser no radiantes cuando la energía se disipa en forma de energía cinética, en forma de calor o procesos de relajación radiantes cuando esta energía tiende a liberarse en forma de radiación
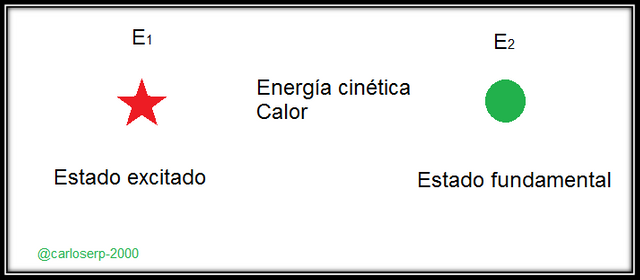
Proceso de relajación
Al nosotros realizar las respectivas medidas por medio de la espectroscopia UV y posteriormente realizar el barrido espectral y representamos gráficamente la intensidad de radiación de la sustancia en función de su longitud de onda, podemos obtener el espectro característica de dicha sustancia que viene siendo su huella dactilar o documento ID, ya que es único de cada sustancia. Estos espectros presentan máximos de energías característicos a longitudes de onda con distintas intensidades, todo esto es sumamente importante para el análisis cualitativo, ya que, al estudiar los máximos de energía de un espectro característico de una sustancia específica, podemos diferenciar uno del otro. Y a su vez también realizar análisis cuantitativo para determinar su concentración que viene siendo mayor la longitud de onda a mayor concentración química.
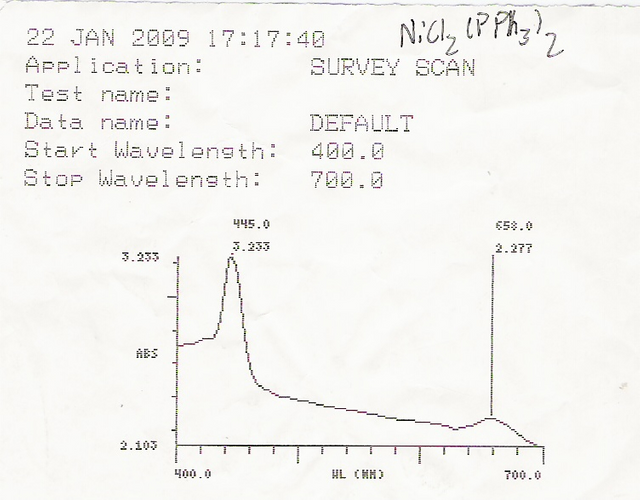
Ejemplo de una lectura del espectro UV / Vis. Imagen de dominio público Wikimedia Commons de Jorfer
Para entender un poco la espectroscopia visible tenemos una sustancia, esta debe tener color para que pueda ser visible, esto significa que la sustancia química absorbe frecuencias y longitudes de onda del rango visible y permite transmitir otras más, todo esto hace posible que nosotros podamos observar el color de una sustancia (es la explicación científica). Un ejemplo sencillo donde podamos comprender esta naturaleza es que tengamos a disposición una sustancia de color amarillo que pertenece al rango visible y esta absorbe una radiación de 430 y 500 nm aproximadamente, en este rango del espectro electromagnético la longitud de onda está situada en el color azul, es decir, la sustancia absorbe el color azul y transmite otros colores que complementan y dan origen al color amarillo.
El principio de la espectroscopia UV consiste en básicamente medir la radiación que absorbe una sustancia en el rango UV, es decir la intensidad del color de una sustancia a una longitud de onda específica y luego realizar una comparación con otras sustancias conocidas, cabe destacar que deben contener la misma especie absorbente.
Para que nosotros podamos obtener esta relación entre sustancias necesitamos de la conocida ley de Beer-Lambert, dicha ley nos dice que, para una misma sustancia absorbente en una celda de espesor constante, la absorbancia es directamente proporcional a la concentración de la sustancia, más adelante mostraré matemáticamente dicha relación.
El color de una sustancia está relacionado con una muestra que sea absorbente y esta coloración puede ser propia de la sustancia o inducida por nosotros. Es muy frecuente inducir la formación de un compuesto con mucho color y que pueda absorber en el rango visible por ejemplo un compuesto colorido como el cloro al reaccionar con otra sustancia como la ortotoluidina, también la cuantificación de la glucosa en la sangre y orina por la acción del molibdato, la intensificación del color del ion-cobre al formar un compuesto amoniaco. Para esto se necesita conocer ciertas condiciones importantes como: temperatura, pH y tiempo.
El método se usa con mayor frecuencia de forma cuantitativa para determinar las concentraciones de una especie absorbente en solución, utilizando la ley de Beer-Lambert:
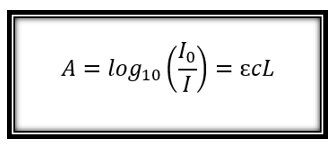
donde A es la absorbancia medida (en unidades de absorbancia UA,
la intensidad de la luz incidente en una longitud de onda determinada, I es la intensidad transmitida, L la longitud del camino a través de la muestra y c la concentración de la especie absorbente. Para cada especie y longitud de onda, ε es una constante conocida como absortividad molar o coeficiente de extinción. Esta constante es una propiedad molecular fundamental en un solvente dado, a una temperatura y presión particulares, y tiene unidades de 1 / M x cm.
La absorbancia y la extinción ε a veces se definen en términos del logaritmo natural en lugar del logaritmo en base 10.
La Ley Beer-Lambert es útil para caracterizar muchos compuestos, pero no es una relación universal para la concentración y absorción de todas las sustancias. En ocasiones, se encuentra una relación polinómica de segundo orden entre la absorción y la concentración para moléculas muy grandes y complejas, como los colorantes orgánicos (naranja de xilenol o rojo neutro, por ejemplo).
Es importante destacar que la ley de Beer-Lambert presenta una serie de limitaciones en su estudio de absorción de sustancias químicas, por ejemplo esta ley sólo puede describir de manera correcta y viable el comportamiento de disoluciones diluidas a una concentración inferior a 10 miliMolar, esto ocurre porque a mayor concentración las distancias entre las moléculas presentes en la sustancia disminuye y comienzan a afectarse electrostáticamente lo que ocurre que disminuya la capacidad de absorción.
Para concluir podemos decir que la espectroscopia UV es muy usada en el área de la química y presenta una infinidad de aplicaciones, nos permite cuantificar sustancias, también poder concentraciones químicas exactas por medio de la interacción de radiación electromagnética con la materia. En química analítica resulta bastante interesante la medida de cantidad de luz que puede absorber una sustancia a cierta longitud de onda, ya que por medio de la ley de Beer-Lambert se puede relacionar esta absorción con su concentración química.
En posteriores publicaciones hablaré más sobre este la espectroscopia de absorción y sus diferentes aplicaciones...espero os gustase mi escrito!
Para más información:
Espectroscopia ultravioleta-visible de wikipedia versión ingles
Espectroscopia ultravioleta-visible de wikipedia versión español
La espectroscopia ultravioletavisible de www.uv.es
Espectrometría ultravioleta-visible de www.espectrometria.com
ESPECTROSCOPIA UV-Visible (UV-VIS) de Mi Septiembre Rojo trabajo en wordpress.com
Espectroscopia visible y ultravioleta de www2.chemistry.msu.edu
Si tienes curiosidad y deseas nutrir tus conocimientos debes leer post científicos de alta calidad, y lo puedes hacer visitando la etiqueta #steemstem y #stem-espanol, es un gran proyecto que ha crecido enormemente en los últimos meses, con el fin de promover altos puestos a publicaciones científicas.

Video credits @gtg
Para obtener más información al respecto, únase a nuestro nuevo servidor en discord

Vota por @stem.witness para testigo AQUÍ

This post has been voted on by the SteemSTEM curation team and voting trail in collaboration with @utopian-io.
If you appreciate the work we are doing then consider voting both projects for witness by selecting stem.witness and utopian-io!
For additional information please join us on the SteemSTEM discord and to get to know the rest of the community!
¡Felicitaciones!
Te participamos que puedes invertir en el PROYECTO ENTROPÍA mediante tu delegación de Steem Power y así comenzar a recibir ganancias de forma semanal transferidas automáticamente a tu monedero todos los lunes. Entra aquí para más información sobre cómo invertir en ENTROPÍA.
Apoya al trail de @Entropia y así podrás ganar recompensas de curación de forma automática. Entra aquí para más información sobre nuestro trail.
Puedes consultar el reporte diario de curación visitando @entropia.
Atentamente
El equipo de curación del PROYECTO ENTROPÍA
Hi @carloserp-2000!
Your post was upvoted by Utopian.io in cooperation with @steemstem - supporting knowledge, innovation and technological advancement on the Steem Blockchain.
Contribute to Open Source with utopian.io
Learn how to contribute on our website and join the new open source economy.
Want to chat? Join the Utopian Community on Discord https://discord.gg/h52nFrV
Arriba arriba @steemitvenezuela.
"Steemitvenezuela es una comunidad en crecimiento que apoya, educa y motiva a los autores con contenido en Español. Juntos somos más y con Steemit podemos lograrlo"
@erickyoussif - Equipo de curación de @SteemitVenezuela
Síguenos y apóyanos en los siguientes enlaces:
Chat de Discord | Grupo FB
Como siempre @carloserp-2000, excelente trabajo, muy bien explicada la Espectroscopia Ultravioleta-Visible. Saludos.