Ciencia de los Materiales: Alótropos cristalinos del carbono. PARTE I
Qué tal amigos de STEEM!
Estoy de vuelta compartiendo con ustedes acerca de un tema bibliográfico que es extremadamente extenso. La Ciencia de los Materiales ha sido de vital importancia para el hombre del último siglo. Como resultado de sus estudios podemos encontrar la relevancia en los nuevos materiales que han sido claves para desarrollar dispositivos electrónicos para la medicina, la comunicación, la construcción, la exploración espacial, entre otros.
La tecnología de los materiales, por su parte, se ha encargado de desarrollar los avances más impactantes de los años recientes. Por ejemplo: los polímeros, los semiconductores, el rayo láser, la fibra óptica entre otros.

MATERIALES CRISTALINOS
Una parte de la Ciencia de los Materiales se ha encargado de estudiar a los materiales cristalinos. Para definir al cristal debemos conocer el concepto de un sólido. El sólido por su parte está directamente relacionado con la periodicidad geométrica del ordenamiento de los átomos o moléculas que definen a un material. De esta manera los materiales se pueden clasificar en amorfos y cristalinos. En los amorfos, los átomos o moléculas pueden estar enlazados con bastante firmeza entre sí, pero no poseen periodicidad geométrica en la forma en que se acomodan (figura 1).
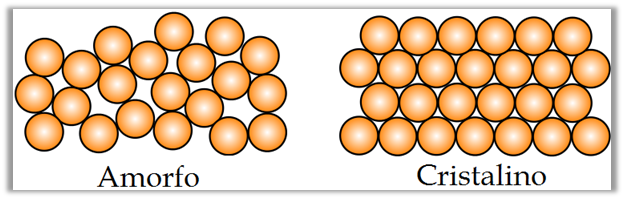
Figura 1. Substancia cristalina y amorfa
| Fuente: Wikipedia, Autor: usuario Sbyrnes321 | Edición: Lic. Daiver Juarez, @djredimi2.
Por otro lado, los materiales cristalinos se caracterizan por tener una periodicidad perfecta en la geometría de su estructura atómica. Incluir la palabra "perfecta" es de vital importancia para la definición de un cristal, ya que la simple presencia de un número relativamente pequeño de imperfecciones en la estructura atómica, puede producir cambios muy notables en el comportamiento del material.
Matemáticamente, la perfección de la periodicidad geométrica puede describirse a través de los 14 diferentes tipos de Estructuras Cristalinas. Para saber más acerca de este tema por favor lee este post: FÍSICA DEL ESTADO SÓLIDO: Introducción a los Semiconductores.
La forma más elemental en que los átomos o moléculas puedes enlazarse es a través de la estructura cristalina Cúbica Simple (figura 2). La estructura cúbica simple constituye también a la celda unitaria primitiva, dado que este contiene el mínimo irreductible de un átomo por cada celda. Confirmamos esto al observar que la estructura cúbica simple tiene ocho átomos en los ocho vértices de la misma, donde, cada átomo es compartido en la misma forma por ocho celdas unitarias adyacentes a cada vértice (ver figura 4). Por lo tanto se puede decir que se tienen 8 átomos en las esquinas y que 1/8 de cada uno de estos pertenece a esta celda en particular, dando un total de un átomo por celda unitaria.
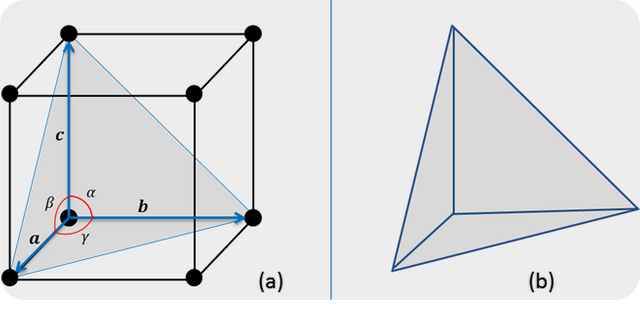
Figura 2. (a) Estructura Cúbica Simple, su celda unitaria primitiva, los vectores y ángulos.
(b) Tetraedro característico de figura anterior. | Fuente: Lic. Daiver Juarez, @djredimi2.
En esto se basan los materiales cristalinos. El tetraedro describe básicamente a todos los materiales cristalinos. Si consideramos al átomo como un tetraedro, para que el material sea un cristal, entonces por cada vértice del mismo debe existir un electrón apareable. De esta manera, el átomo quedará dispuesto a compartir 4 electrones con otro átomo del mismas características. La forma en que estos átomos están enlazados, es a través de enlaces covalentes. A esto se le conoce como un material tetravalente.
Basándonos químicamente, esto es la Regla del Octeto. Esta dice que todos los átomos tienden a alcanzar el equilibrio energético con ocho electrones en su ultima capa de valencia.
Sin embargo, existen algunos elementos que naturalmente cumplen con estas reglas. Estos son los elementos que constituyen al grupo IV de la tabla periódica. Esto se debe a que poseen 4 electrones en la última capa de valencia. De esta manera, si tenemos un material constituido por átomos de alguno de estos elementos en su estado puro, entonces este se comportará con un cristal. Para el caso de una red cristalina bidimensional constituida por átomos de Carbono, tenemos la figura 3.

Figura 3. Red cristalina bidimensional formada por átomos de carbono.
| Fuente: Lic. Daiver Juarez, @djredimi2.
Para el caso de una red cristalina tridimensional, presentamos un red compuesta de estructuras cristalinas cúbicas simples mediante la figura 4.
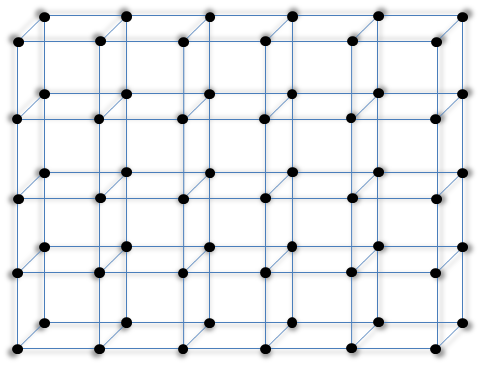
Figura 4. Red cristalina formada por átomos contenidos en estructuras cúbicas simples.
| Fuente: Lic. Daiver Juarez, @djredimi2.
ALOTROPÍA
La configuración mostrada en la figura 3 y la figura 4 no es la única que pueden adaptar los materiales. Este ordenamiento puede ser afectado por dos consideraciones:
- Según su estructura cristalina (14 tipos).
- Por diferencias en su estructura molecular (Forma de los orbitales).
La primera de estas ya fue comentada al principio del post. Sin embargo la segunda, está estrictamente relacionada con la propiedad que tienen algunos elementos de presentarse en dos o más formas diferentes, pero sin cambiar su estado físico. Como los cristales son materiales en estado sólido, podemos definir la alotropía como la propiedad que poseen algunos elementos químicos (como el carbono) de cambiar su estructura molecular en dos o mas formas, pero sin cambiar su estado sólido.
El uso del término "alotropía" está limitado a los elementos químicos. Para los compuestos, el término empleado es "Poliformismo". Un alótropo puede exhibir cambios en sus propiedades físicas y químicas. El cambio entre las formas alotrópicas se desencadena por las fuerzas externas que afectan las estructuras, como la presión, la luz y la temperatura.
ALÓTROPOS DEL CARBONO
El Carbono es un elemento químico de nomenclatura "C" y de número atómico 6. Pertenece al grupo 14 o IVB de la tabla periódica y es un no-metal en su estado elemental. Es el cuarto elemento mas abundante en el universo por masa después del hidrógeno, el helio y el oxígeno.
El carbono es uno de los elementos con mayor numero de alótropos. Esto se debe a su alta capacidad de catenarse. Es decir, a su facilidad con que puede formar enlaces covalentes con otros átomos de carbono y así formar cadenas y estructuras muy grandes. En esta ocasión les voy a exponer sólo 5 de los más relevantes.
Diamante
Todos la conocemos como la piedra más preciosa y dura que existe. Sin embargo, en realidad, es una forma sólida de Carbono puro con átomos arraigados en una estructura cristalina cúbica de diamante. Su estructura cristalina está formada por celdas unitarias apiladas juntas (figura 5). Aunque hay 18 átomos en la figura, cada átomo de los vértices está compartido por ocho celdas unitarias y cada átomo en el centro de una cara está compartido por dos, por lo que hay un total de ocho átomos por cada celda. Cada lado de la celda unitaria tiene un valor 3,57 angstroms de longitud.
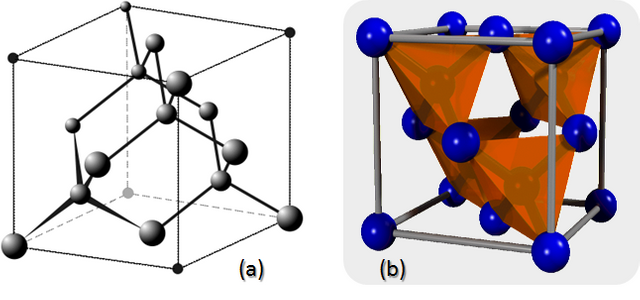
Figura 5. (a) Estructura cristalina cúbico de diamante. (b) Celdas unitarias de la estructura cristalina cúbica de diamante.
Fuente (a): Wiki Autor: Pseudomoi. Fuente (b): Wiki, Autor: Pieter Kuiper | Edición: Lic. Daiver Juarez, @djredimi2.
Una celda cúbica de diamante se puede considerar como dos celdas cúbicas centradas en las caras superpuestas y desplazadas por 1/4 de la diagonal a lo largo de una celda cúbica. Los diamantes también pueden formar una estructura cristalina que se conoce como diamante hexagonal o Lonsdaleita , pero esta es mucho menos común y se forma bajo diferentes condiciones del carbono cúbico.
El uso más común del diamante es en el corte industrial a través del uso de taladros, esmeriles, etc. En estos, pequeños diamantes están incrustados en las puntas, en las hojas de sierra, o se muelen hasta formar un polvo para emplear el pulido. Debido a los avances en la producción de diamantes sintéticos, las aplicaciones futuras pueden ser muy factibles.
Grafito
A este muchos los conocemos porque forma parte de nuestra vida estudiantil, es decir, la punta del lápiz. Desde el punto de vista químico, el grafito es una forma cristalina del carbono con sus átomos dispuestos en una estructura hexagonal (figura 6). En condiciones naturales, a presión y temperatura ambiental es la forma más estable del carbono. A presiones y temperaturas altas el carbono se convierte en diamante.
Así como se emplea en la industria textil para los lapices, también se emplea en los lubricantes, y debido a su alta conductividad eléctrica se usa en la electrónica como electrodo.
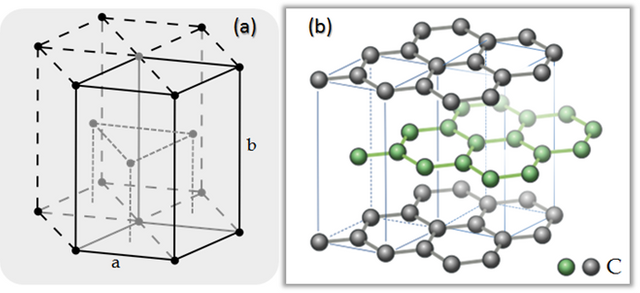
Figura 6. (a) Estructura cristalina hexagonal. (b) Celdas unitarias de la estructura cristalina hexagonal del grafito.
Fuente (a): Wiki, Autor: DePiep. Fuente (b): Wiki, Autor: Jojko sivek | Edición: Lic. Daiver Juarez, @djredimi2.
El grafito tiene una estructura en capas planas. En cada capa, los átomos de carbono están dispuestos en una red de tipo panal con una separación de 0,142 nm, y la distancia entre planos es de 0,335 nm. Los átomos en el plano están unidos por enlaces covalentes, con solo tres de los cuatro electrones enlazados potencialmente. El cuarto electrón es libre para migrar en el plano, lo que hace que el grafito sea eléctricamente conductor. Sin embargo, no conduce en una dirección de ángulos rectos al plano. La unión entre capas se realiza mediante enlaces débiles de van der Waals, que permiten, a su vez, que las capas de grafito se separen fácilmente o se deslicen unas sobre otras.
Existen dos formas para el grafito estas son, "alfa" de estructura hexagonal(figura 6) y "beta" de estructura romboédrica. Ambas tienen propiedades físicas muy similares, excepto que las capas de grafeno se apilan de forma ligeramente diferente. El grafito alfa puede ser plano o abrochado. La forma alfa se puede convertir a la forma beta mediante un tratamiento mecánico. Por último, la forma beta vuelve a la forma alfa cuando se calienta a más de 1300 °C.
Grafeno
Es curioso que tenga un nombre parecido al punto anterior. Pues existe una estrecha relación entre ambos. Este alótropo del carbono, consiste en una sola capa de átomos de carbono dispuestos en una red hexagonal. En otras palabras, el grafeno representa todo un plano formado por hexágonos en 2D, en la que todos sus vértices contienen átomos de carbono (figura 7). Esto quiere decir, que es la estructura más elemental en comparación con los otros alótropos. Por ejemplo, el grafito tiene una estructura formada por capas de grafeno.

Figura 7. Plano cristalino hexagonal del Grafeno.
Fuente: Wiki, Autor: AlexanderAlUS | Edición: Lic. Daiver Juarez, @djredimi2.
El grafeno tiene muchas propiedades poco comunes. Una de ella es que es el material hipotéticamente más resistente. Conduce el calor y la electricidad eficientemente y es casi transparente. Este alótropo presenta un diamagnetismo alto y no lineal, mayor que el del grafito, y puede ser levitado por imanes de neodimio.
El grafeno es un semiconductor transparente y flexible que promete varias aplicaciones en dispositivos, como las celdas solares, diodos emisores de luz (LED), paneles o micas táctiles y pantallas de teléfonos inteligentes. El grafeno también se ha utilizado en otros dispositivos electrónicos fundamentales, como los capacitores y los transistores de efecto de campo (FET).
Actualmente se emplea la búsqueda de múltiples aplicaciones debido a las excelentes propiedades que encontramos en los alótropos del carbono, por lo que hoy día, es común leer o escuchar a cerca de este material como promesas tecnológicas.
Sin embargo, estos tres alótropos tan sólo son los primeros mostrados. En el próximo post les estaré hablando de las nanoestructuras cristalinas como lo son los fulerenos y los nanotubos de carbono.
Espero haya sido de su agrado leer acerca de este grandioso material.
REFERENCIAS CONSULTADAS
[1] Mckelvey, John P. (1976). Física del estado sólido y de semiconductores. México. Editorial Limusa. P.13-18 y P.269-284.
[2] Smith, William F. (2006). "Fundamentos de la ciencia e ingeníeria de materiales". México. Editorial McGRAW-HILL Interamericana. 4ta edicion. Traducido por Gabriel Cázares y Pedro González.
[3] Callister, William Jr. (1985) "Introducción a la Ciencia e Ingeniría de los Materiales". Editorial Reverté.

@djredimi2 Te invita a formar parte de la sub-comunidad #stem-espanol, compartiendo temas de interés en Ciencia, Tecnología, Ingeniería o Matemáticas (STEM) en idioma Español. Si estás interesado en unirte al grupo de stem-espanol, te invito cordialmente a chat oficial registrándote en discordapp y accediendo luego a este enlace.

Conoce todo sobre el logo visitando este enlace.
satos muy interesantes para la fisica y quimica!! que interesante
This post has been voted on by the SteemSTEM curation team and voting trail in collaboration with @curie.
If you appreciate the work we are doing then consider voting both projects for witness by selecting stem.witness and curie!
For additional information please join us on the SteemSTEM discord and to get to know the rest of the community!
Thanks you bot friend.
Congratulations @djredimi2! You have completed the following achievement on the Steem blockchain and have been rewarded with new badge(s) :
Click here to view your Board of Honor
If you no longer want to receive notifications, reply to this comment with the word
STOP