Biología y química de la mano: Conductividad eléctrica, practica de laboratorio, en el marco de la enseñanza de las ciencias.
Hola a todos

Fuente de la imagen: Propia
Introducción
La enseñanza de la ciencia es objeto de estudio de numerosas investigaciones, contando con muchas revistas especializadas para su publicación. Dentro de las líneas, están las estrategias para la enseñanza y aprendizaje de las ciencias naturales, en las cuales podemos ubicar a la química y la biología; ambas que van de la mano para enseñar los tópicos en los distintos niveles de enseñanza, de hecho al revisar temas de biología como las enzimas, la bomba de sodio y potasio, el origen de la vida, proteínas y otros más, indiscutiblemente se debe considerar a la química para dar un mayor entendimiento de la temática a explicar.
Por ello para esta ocasión voy a compartir con ustedes una práctica de laboratorio del área de química, conjuntamente con una importancia en el campo de la biología. Dicha práctica, fue elaborada con los estudiantes. Como muchas investigaciones indican, estas actividades así como las salidas al campo, son experiencias en el campo de la ciencia con un aspecto significativo para el estudiante, puesto que el mismo está desarrollando su aspecto cognitivo e investigativo.

Fuente de la imagen: Propia y editada en power point.
La práctica corresponde a la conductividad de la corriente, observando sustancias electrolíticas y no electrolíticas.
A continuación una breve explicación teórica:
Las sustancias que se disuelven en agua originan dos tipos de soluciones acuosas, los electrolitos y los no electrolitos. En el primero tenemos a unas sustancias que presentan soluciones capaces de conducir corriente eléctrica, puesto que al disolverse en agua tienen a disociarse (o se ionizan), es decir a separarse generando partículas cargadas positivamente y otras con carga negativas llamadas iones. Dicho esto, la corriente eléctrica es transportada mediante la solución acuosa (ac) gracias al constante movimiento de los iones.
En otras palabras, las soluciones electrolíticas, el soluto disuelto en ella, llamado electrolito, se descompone con carga eléctrica positiva y negativa denominadas iones, encargadas de transportar la electricidad. Los electrolitos son: ácidos, bases y sales.
Algunas ecuaciones para la disociación de ciertas sustancias son:
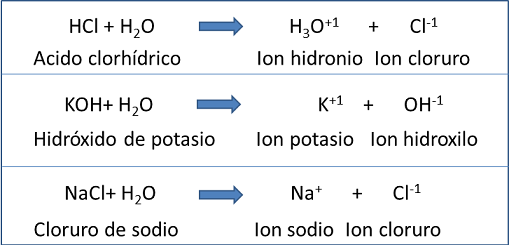
Fuente de la imagen: Propia y editada en power point.
De tal manera, que dependiendo de su capacidad para transmitir la corriente eléctrica, los electrolitos pueden ser:
Fuertes: prácticamente se descomponen en iones en su totalidad (100%), en sus soluciones acuosas la concentración de iones es elevada, y son excelentes conductores de la electricidad.

Fuente de la imagen: Propia y editada en power point.
Débiles: En sus soluciones acuosas la concentración de iones es baja (menos del 5%), son malas conductores de la electricidad.
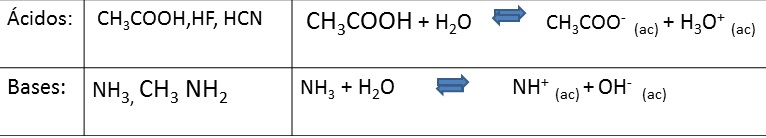
Fuente de la imagen: Propia y editada en power point.
Vale de decir, que la doble flecha para estos casos indica que el equilibrio que se establece entre la fracción no ionizada o molecular y la fracción ionizada.
Por otra parte tenemos a las soluciones no electrolíticas; en estas el soluto disuelto en ellas, llamado no electrolito, mantiene su identidad como moléculas, es decir, no se descomponen en iones y no puede conducir la corriente eléctrica.
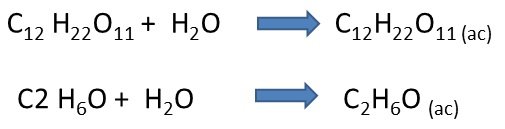
Fuente de la imagen: Propia y editada en power point.
Formación de iones: Los iones o partículas con carga eléctrica negativa y positiva es posible su formación mediante dos procesos; disociación e ionización.
Disociación: Es cuando una molécula hay separación para la aparición de estructuras más sencillas o en sus átomos. Por ejemplo, cuando el cloruro de sodio, compuesto ionico, se disuelve en agua se forman pequeñas partículas, iones Na+ y Cl-, que se separan del sólido rompiendo las fuerzas de atracción que las mantiene unidas a él, y se mezclan las moléculas de agua que actúa como medio de transporte de los iones.

Fuente de la imagen: Propia y editada en power point.
Ionización: Es cuando es posible obtener iones, tanto con cargas eléctricas positivos que serían los cationes o negativos que serían los aniones. Este proceso o método de conversión podemos obtener a partir de una molécula a través de una reacción átomos con iones. Por ejemplo, el cloruro de hidrogeno y agua ambas puras son pésimos conductores, sin embargo, al disolver el cloruro de hidrogeno (HCL) en agua (H2O), podemos obtener una solución conductora de electricidad.

Fuente de la imagen: Propia y editada en power point.
Momento de la practica
La conductividad eléctrica es una capacidad, variable, propiedad, que poseen algunas sustancias para transmitir una corriente eléctrica. Entonces, para comprobar la existencia de iones en un solución dada, podemos emplear una herramienta que puede demostrar la conductividad. Para este caso fue utilizado un bombillo conectado a una fuente con electricidad, con dos cables para corroborar la conductividad eléctrica con la sustancia. El bombillo, se prende o se enciende si al colocar los dos cables en la solución hay una presencia del conductor eléctrico.

Fuente de la imagen: Propia y editada en power point.
Así pues para el reconocimiento de electrolito, podemos tener en cuenta para la practica las siguientes cosas:
- Recipientes de boca ancha o vaso precipitado, los cuales deben ser enumerados o etiquetados
- Para cada uno pueden agregar alrededor de unos 10ml de la solución
- Luego, introducir el par de cables para observar su la soluciones es buena o mala conductora de electricidad.
- Se debe de tener cuidado con los cables, no pueden estar en contacto uno con otro en la soluciones, deben limpiarse bien cuando se pruebe con otra muestra, solamente estarán en contacto uno con el otro para corroborar que la fuente de corriente este funcionando.

Fuente de la imagen: Propia y editada en power point.
En este cuadro es posible denotar las soluciones y corroborar cuales son conductoras fuertes, débiles, y no conductoras.
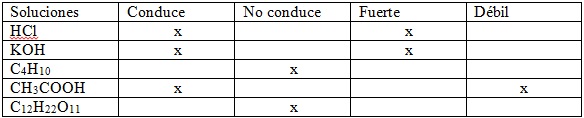
Fuente de la imagen: Propia y editada en power point.
Después de marcar las casillas del cuadro, podemos ver algunas reacciones:
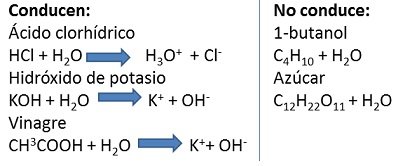
Fuente de la imagen: Propia y editada en power point.
Reflexión
Considerando a la química como parte fundamental para la enseñanza de la biología, así como considerar la estadística para las estrategias de enseñanza de la biología evolutiva, es sumamente importante en el quehacer educativo. Con este tipo de practica, coordinado con el profesor(a) de química es posible reforzar temas de biología tales como la célula, el estudio del transporte de sustancia en la célula, la membrana celular, o cualquier otro.
Referencia de la información
- H. Curtis. Biología general
- Trujillo. Soluciones acuosas: teoría y aplicaciones. Módulo de apoyo académico en Química
- Aportes para la enseñanza para el nivel medio. Consultado 2018
Gracias.
Biologia y quimica uhmmm se me viene en mente la sopa primordial..... Se quedo esperando las celulas Oparin jaja
A muchos, por la bioquímica :). Jejeje, al parecer si. Gracias por comentar.
¡Felicitaciones tu publicación ha sido seleccionada para recibir el Upvote y Resteem del Proyecto de Curación @Codebyte!
Si deseas apoyarnos y saber mas sobre este proyecto puedes seguirlo y estar atento a sus publicaciones. Ingresando aquí podrás ver el reporte en donde tu publicación ha sido destacada.
Gracias :D
Hola @hogarcosmico. Muy buena explicación práctica de la conductividad eléctrica. Su post ha sido votado por @ramonycajal. Proyecto de curación de posts de ciencias del witness @cervantes. Un saludo.
Muchas gracias por sus palabras y el apoyo. Feliz día.